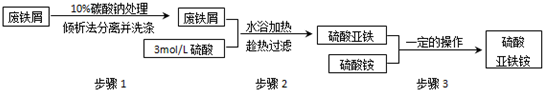
分析:A.加入20mL盐酸,不产生气体,说明发生反应:CO
32-+H
+═HCO
3-;
B.加入80mL盐酸生成气体体积为2520mL,大于加入60mL盐酸时生成的气体体积,故加入40mL、60mL盐酸时,盐酸不足,完全反应,发生反应:NaHCO
3+HCl=NaCl+CO
2↑+H
2O,加入50mL盐酸产生的气体体积为加入40mL盐酸产生的气体及在40mL基础上再加入10mL盐酸产生的气体体积之和,结合40mL~60mL之间消耗盐酸体积与生成气体体积的定比关系计算;40mL~60mL之间消耗20mL盐酸,生成气体1680mL-560mL=1120mL;
C.发生反应:NaHCO
3+HCl=NaCl+CO
2↑+H
2O,根据盐酸和二氧化碳之间的关系式计算盐酸浓度;
D.发生反应:NaHCO
3+HCl=NaCl+CO
2↑+H
2O,生成560mL二氧化碳消耗盐酸的体积=
×20mL=10mL,故加入前30mL盐酸,发生反应Na
2CO
3+HCl=NaCl+NaHCO
3,30mL~75mL发生反应:NaHCO
3+HCl=NaCl+CO
2↑+H
2O,由两阶段消耗的盐酸体积,可计算天然碱中Na
2CO
3、NaHCO
3的物质的量之比,再根据生成二氧化碳计算各自物质的量,根据质量守恒计算结晶水的质量,进而计算结晶水的物质的量,确定三者比例关系,进而确定天然碱的化学式.
解答:
解:A.加入20mL盐酸,不产生气体,说明发生反应:CO
32-+H
+═HCO
3-,故A正确;
B.加入80mL盐酸生成气体体积为2520mL,大于加入60mL盐酸时生成的气体体积,故加入40mL、60mL盐酸时,盐酸不足,完全反应,发生反应:NaHCO
3+HCl=NaCl+CO
2↑+H
2O,40mL~50mL之间消耗10mL盐酸,生成气体体积为(1680mL-560mL)×
=560mL,故加入50mL盐酸产生的气体体积为:560mL+560mL=1120mL,故B正确;
C.40mL~60mL之间消耗20mL盐酸,生成气体1680mL-560mL=1120mL,发生反应:NaHCO
3+HCl=NaCl+CO
2↑+H
2O,设盐酸的浓度为c,
NaHCO
3+HCl=NaCl+CO
2↑+H
2O
1 1
0.02cmol
1:1=0.02cmol:
c=2.5mol/L,故C正确;
D.发生反应:NaHCO
3+HCl=NaCl+CO
2↑+H
2O,生成560mL二氧化碳消耗盐酸的体积=
×20mL=10mL,故加入前30mL盐酸,发生反应Na
2CO
3+HCl=NaCl+NaHCO
3,从产生气体到生成2520mL二氧化碳消耗盐酸的体积=
×10mL=45mL,即完全生成气体共消耗盐酸30+45=75mL,30mL~75mL发生反应:NaHCO
3+HCl=NaCl+CO
2↑+H
2O,
令天然碱中Na
2CO
3、NaHCO
3的物质的量为amol、bmol,则:
Na
2CO
3+HCl=NaCl+NaHCO
3,
amol amol amol
NaHCO
3 +HCl=NaC l+CO
2↑+H
2O,
(a+b)mol (a+b)mol (a+b)mol
故amol:(a+b)mol=30mL:45mL,则a:b=2:1,由生成二氧化碳可知(a+b)mol=0.1125mol,解得a=0.075、b=0.0375,故天然碱中结晶水的质量=12.45g-0.0375mol×84g/mol-0.075mol×106g/mol=1.35g,结晶水的物质的量=
=0.075mol,
则天然碱中n(Na
2CO
3):n(NaHCO
3):n(H
2O)=0.075mol:0.0375mol:0.075mol=2:1:2,
故天然碱的化学式为:2Na
2CO
3?NaHCO
3?2H
2O,故D错误;
故选D.



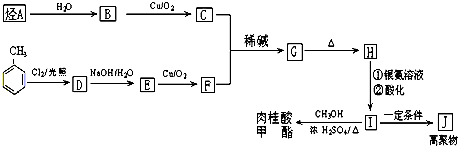
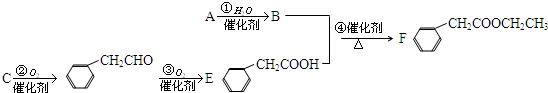
 肉桂酸甲酯是调制具有草莓、葡萄、樱桃、香子兰等香味的食用香精,用于肥皂、洗涤剂、风味剂和糕点的调味,在医药工业中作为有机合成的中间体.
肉桂酸甲酯是调制具有草莓、葡萄、樱桃、香子兰等香味的食用香精,用于肥皂、洗涤剂、风味剂和糕点的调味,在医药工业中作为有机合成的中间体.