
 肉桂酸甲酯是调制具有草莓、葡萄、樱桃、香子兰等香味的食用香精,用于肥皂、洗涤剂、风味剂和糕点的调味,在医药工业中作为有机合成的中间体.
肉桂酸甲酯是调制具有草莓、葡萄、樱桃、香子兰等香味的食用香精,用于肥皂、洗涤剂、风味剂和糕点的调味,在医药工业中作为有机合成的中间体.
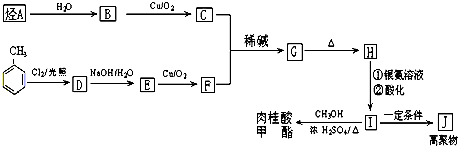
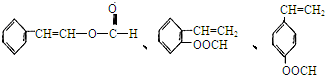
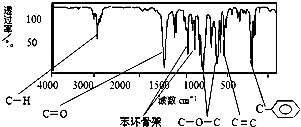
 ,C-O-C,C=O,属于甲醇形成的酯,分子中碳原子数目至少为10个碳原子(碳碳双键、苯环、酯基-COOCH3),至少2个O原子,10个碳原子、2个氧原子总相对原子质量为120+32=152,质谱分析其分子的相对分子质量为162,故含有10碳原子、2个氧原子,分子中氢原子数目为162-152=10,故分子式为C10H10O2,它的核磁共振氢谱图有6个峰,其面积之比为1:2:2:1:1:3,不可能含有2个侧链,只能含有1个侧链,其结构简式为:
,C-O-C,C=O,属于甲醇形成的酯,分子中碳原子数目至少为10个碳原子(碳碳双键、苯环、酯基-COOCH3),至少2个O原子,10个碳原子、2个氧原子总相对原子质量为120+32=152,质谱分析其分子的相对分子质量为162,故含有10碳原子、2个氧原子,分子中氢原子数目为162-152=10,故分子式为C10H10O2,它的核磁共振氢谱图有6个峰,其面积之比为1:2:2:1:1:3,不可能含有2个侧链,只能含有1个侧链,其结构简式为: ;
; ,I发生加聚反应生成高聚物J为
,I发生加聚反应生成高聚物J为 ,H发生要银镜反应、酸化得到I,故H为
,H发生要银镜反应、酸化得到I,故H为 ,C与F发生醛的加成反应生成所生产的G,G脱水生成H,则F为
,C与F发生醛的加成反应生成所生产的G,G脱水生成H,则F为 ,G为
,G为 ,故甲苯与氯气发生甲基上的取代反应生成D为
,故甲苯与氯气发生甲基上的取代反应生成D为 ,D发生发生水解反应生成E为
,D发生发生水解反应生成E为 ,E发生氧化反应生成F,据此解答.
,E发生氧化反应生成F,据此解答. ,C-O-C,C=O,属于甲醇形成的酯,分子中碳原子数目至少为10个碳原子(碳碳双键、苯环、酯基-COOCH3),至少2个O原子,10个碳原子、2个氧原子总相对原子质量为120+32=152,质谱分析其分子的相对分子质量为162,故含有10碳原子、2个氧原子,分子中氢原子数目为162-152=10,故分子式为C10H10O2,它的核磁共振氢谱图有6个峰,其面积之比为1:2:2:1:1:3,不可能含有2个侧链,只能含有1个侧链,其结构简式为:
,C-O-C,C=O,属于甲醇形成的酯,分子中碳原子数目至少为10个碳原子(碳碳双键、苯环、酯基-COOCH3),至少2个O原子,10个碳原子、2个氧原子总相对原子质量为120+32=152,质谱分析其分子的相对分子质量为162,故含有10碳原子、2个氧原子,分子中氢原子数目为162-152=10,故分子式为C10H10O2,它的核磁共振氢谱图有6个峰,其面积之比为1:2:2:1:1:3,不可能含有2个侧链,只能含有1个侧链,其结构简式为: ,
, ;
; ,I发生加聚反应生成高聚物J为
,I发生加聚反应生成高聚物J为 ,H发生要银镜反应、酸化得到I,故H为
,H发生要银镜反应、酸化得到I,故H为 ,C与F发生醛的加成反应生成所生产的G,G脱水生成H,则F为
,C与F发生醛的加成反应生成所生产的G,G脱水生成H,则F为 ,G为
,G为 ,故甲苯与氯气发生甲基上的取代反应生成D为
,故甲苯与氯气发生甲基上的取代反应生成D为 ,D发生发生水解反应生成E为
,D发生发生水解反应生成E为 ,E发生氧化反应生成F,
,E发生氧化反应生成F, ,故答案为:
,故答案为: ;
; ,含有的官能团有:醛基、羟基,故答案为:醛基、羟基;
,含有的官能团有:醛基、羟基,故答案为:醛基、羟基; 发生消去反应生成
发生消去反应生成 ,故答案为:消去;
,故答案为:消去;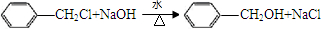 ,
,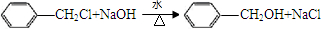 ;否,碳碳双键能被酸性高锰酸钾溶液氧化;
;否,碳碳双键能被酸性高锰酸钾溶液氧化; )的同分异构体共有5种:A.能发生水解反应,含有酯基,B.与银氨溶液作用出现光亮的银镜,结合A可知,含有甲酸形成的酯基,C.能与溴发生加成反应,含有碳碳双键,除
)的同分异构体共有5种:A.能发生水解反应,含有酯基,B.与银氨溶液作用出现光亮的银镜,结合A可知,含有甲酸形成的酯基,C.能与溴发生加成反应,含有碳碳双键,除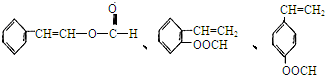 外,另两种同分异构体的结构简式为:
外,另两种同分异构体的结构简式为: ,
, ,故答案为:
,故答案为: ,
, .
.


 鸿图图书寒假作业假期作业吉林大学出版社系列答案
鸿图图书寒假作业假期作业吉林大学出版社系列答案科目:高中化学 来源: 题型:

A、
| ||||
| B、形成简单离子的半径从小到大的顺序是W+<Q3+<Z3- | ||||
| C、科学家建议将X与Y排在同一主族,是因为它们形成的化合物最多 | ||||
| D、Z的最高价氧化物对应水化物的酸性比R的最高价氧化物对应水化物的酸性强 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、此陨石是一种纯度较高的硅酸盐矿石 |
| B、此陨石具有耐酸碱的特性 |
| C、陨石中含有游离态的铁是因为在外太空中铁的活性比地球上铁的活性低 |
| D、橄榄石中Fe为+2价 |
查看答案和解析>>
科目:高中化学 来源: 题型:
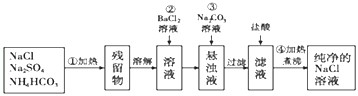
查看答案和解析>>
科目:高中化学 来源: 题型:

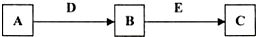
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 盐酸体积(mL) | 20 | 40 | 60 | 80 |
| 产生气体体积(mL) | 0 | 560 | 1680 | 2520 |
| A、加入盐酸体积小于20 mL时,体系发生的离子反应为:CO32-+H+═HCO3- |
| B、加入盐酸体积为50 mL时,产生气体(标准状况)的体积为1120mL |
| C、本实验使用盐酸的浓度为2.5 mol?L-1 |
| D、该天然碱的化学式为Na2CO3?2NaHCO3?2H2O |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com