
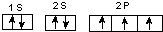
 ;A、C形成的化合物A2C2分子的电子式为
;A、C形成的化合物A2C2分子的电子式为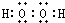 ,属于极性分子,
,属于极性分子, ;极性;
;极性;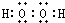 ;
;| 5+1-2×3 |
| 2 |


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
| A、1molCH4分子共价键总数为NA |
| B、含NA个Na+的Na2O2溶于1L水中,Na+的物质的量浓度为1mol/L |
| C、常温常压下,14g由N2与CO组成的混合气体含有的原子数目为NA |
| D、1molMg与足量O2或N2反应生成MgO或Mg3N2失去电子分别为2NA和3NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
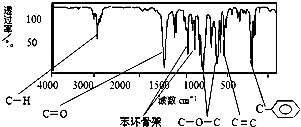 肉桂酸甲酯是调制具有草莓、葡萄、樱桃、香子兰等香味的食用香精,用于肥皂、洗涤剂、风味剂和糕点的调味,在医药工业中作为有机合成的中间体.
肉桂酸甲酯是调制具有草莓、葡萄、樱桃、香子兰等香味的食用香精,用于肥皂、洗涤剂、风味剂和糕点的调味,在医药工业中作为有机合成的中间体.
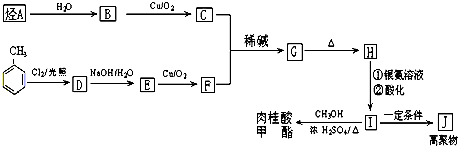
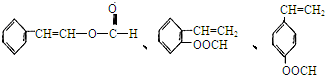
查看答案和解析>>
科目:高中化学 来源: 题型:
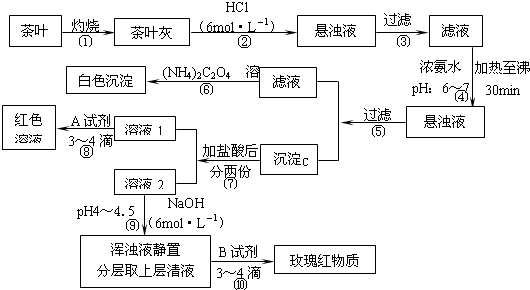
查看答案和解析>>
科目:高中化学 来源: 题型:
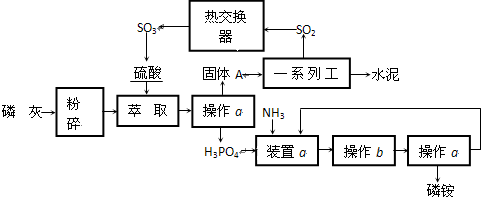
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、CH3(CH2)3CH2OH |
| B、CH3CH2CH(CH3)CH2OH |
| C、(CH3)2CHCH2CH2OH |
| D、(CH3CH2)2CHOH |
查看答案和解析>>
科目:高中化学 来源: 题型:
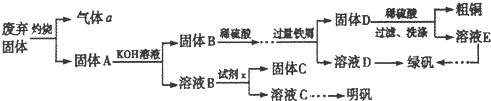
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
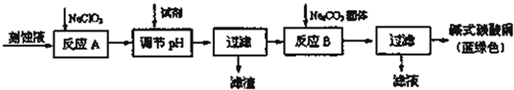
| 物质 | Cu(OH)2 | Fe(OH)2 | Fe(OH)3 |
| 开始沉淀pH | 6.0 | 7.5 | 1,4 |
| 沉淀完全pH | 13 | 14 | 3.7 |
查看答案和解析>>
科目:高中化学 来源: 题型:
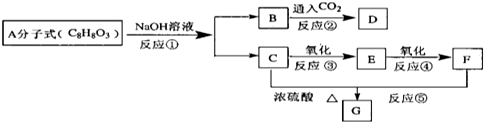
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com