

| Fe |
| Cu |
| ||
| ||
| Fe |
| Cu |


科目:高中化学 来源: 题型:
| A、两个反应中生成等量的I2时转移的电子数相等 |
| B、I2在反应①②中都是氧化产物 |
| C、NaI和NaIO3在一定条件下能反应生成I2 |
| D、NaIO3在任何化学反应中只能作氧化剂,不能作还原剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:
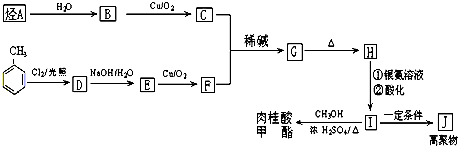
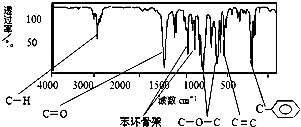 肉桂酸甲酯是调制具有草莓、葡萄、樱桃、香子兰等香味的食用香精,用于肥皂、洗涤剂、风味剂和糕点的调味,在医药工业中作为有机合成的中间体.
肉桂酸甲酯是调制具有草莓、葡萄、樱桃、香子兰等香味的食用香精,用于肥皂、洗涤剂、风味剂和糕点的调味,在医药工业中作为有机合成的中间体.
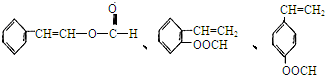
查看答案和解析>>
科目:高中化学 来源: 题型:
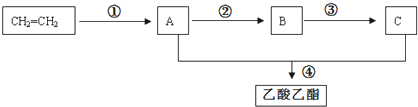
查看答案和解析>>
科目:高中化学 来源: 题型:
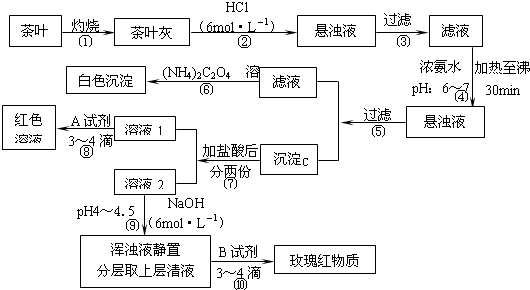
查看答案和解析>>
科目:高中化学 来源: 题型:
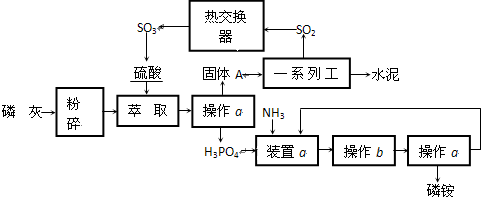
查看答案和解析>>
科目:高中化学 来源: 题型:
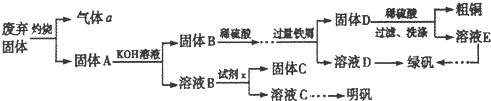
| ||
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com