


科目:高中化学 来源: 题型:
| A、Fe3+、O2、H2O2三种微粒都具有氧化性,没有还原性 |
| B、木炭与浓硝酸反应可能生成CO和NH4NO3 |
| C、因为SO2具有还原性,所以不能用浓H2SO4干燥SO2 |
| D、Cl2转变为HClO时一定需要加入氧化剂才能实现 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、常温常压下,23g NO2含有NA个氧原子 |
| B、标准状况下,22.4L H2O含有NA个H2O分子 |
| C、含10 NA个电子的N2分子的物质的量是1mol |
| D、0.1mol/L的Ba(OH)2溶液中,OH-的个数为0.2NA个 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、用盐酸清除水垢CaCO3+2H+=Ca2++CO2↑+H2O |
| B、Fe跟稀硫酸反应:Fe+2H+=Fe2++H2↑ |
| C、澄清石灰水跟稀盐酸:H++OH-=H2O |
| D、碳酸氢钠溶液跟氢氧化钠溶液反应 HCO3-+OH-=H2O+CO2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、此陨石是一种纯度较高的硅酸盐矿石 |
| B、此陨石具有耐酸碱的特性 |
| C、陨石中含有游离态的铁是因为在外太空中铁的活性比地球上铁的活性低 |
| D、橄榄石中Fe为+2价 |
查看答案和解析>>
科目:高中化学 来源: 题型:

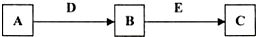
查看答案和解析>>
科目:高中化学 来源: 题型:
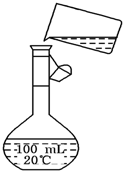 电解法制碱的主要原料是饱和食盐水,由于粗盐水中含有泥沙、Ca2+、Mg2+、Fe3+、SO
电解法制碱的主要原料是饱和食盐水,由于粗盐水中含有泥沙、Ca2+、Mg2+、Fe3+、SO2- 4 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com