
| n |
| V |


科目:高中化学 来源: 题型:
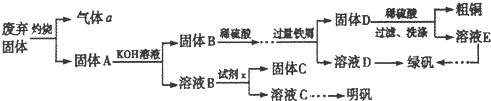
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
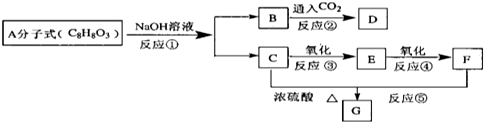
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、①② | B、②③ | C、①④ | D、④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、溶解后未冷却至室温就移入容量瓶 |
| B、向容量瓶加水时液面低于刻度线即摇匀 |
| C、称量时间过长 |
| D、向容量瓶加水定容时眼睛俯视刻度线 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| PH | 6.5-8.5 |
| Ca2+、Mg2+总浓度 | <0.0045mol?L-1 |
| 细菌总数 | <100个?mL-1 |
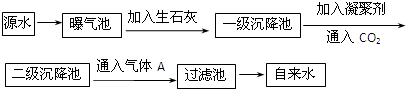
查看答案和解析>>
科目:高中化学 来源: 题型:
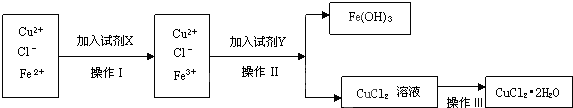
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、溶液中粒子浓度大小关系为:c(H+)>c(CH3COO-)>c(CH3COOH)>c(OH-) |
| B、加水稀释到原体积的10倍后溶液pH变为4 |
| C、加入少量乙酸钠固体,溶液pH升高 |
| D、与等体积、pH=3的盐酸比较,跟足量锌粒反应产生的H2一样多 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com