
硫酸亚铁是一种重要的化工原料,可以制备一系列物质(如图所示)。下列说法错误的是
| A.碱式硫酸铁水解能产生Fe(OH)3胶体,可用作净水剂 |
| B.为防止NH4HCO3分解,生产FeCO3需在较低温度下进行 |
| C.可用KSCN溶液检验(NH4)2Fe(SO4)2是否被氧化 |
| D.常温下,(NH4)2Fe(SO4)2在水中的溶解度比FeSO4的大 |
科目:高中化学 来源: 题型:单选题
下列有关铁元素的叙述中正确的是 ( )
| A.Fe(OH)2易被氧化生成Fe(OH)3,说明稳定性:Fe(OH)2<Fe(OH)3 |
| B.铁是较活泼的金属,它与卤素(X2)反应的生成物均为FeX3 |
| C.氢氧化铁与氢碘酸反应:Fe(OH)3+3HI→FeI3+3H2O |
| D.铁元素位于周期表的第五周期第VIII族 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
一些不法商人在面粉生产中添加过氧化钙(CaO2)等添加剂对食品进行增白。下列关于过氧化钙(CaO2)的叙述正确的是
| A.CaO2中阴、阳离子的个数比为1:1 |
| B.CaO2对面粉增白原理与SO2漂白原理相似 |
| C.CaO2和水反应时,每产生1 molO2转移电子4 mol |
| D.CaO2放入NaHCO3溶液中,会放出二氧化碳,并产生白色浑浊 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
下列实验方案中,不能测定Na2CO3和NaHCO3,混合物中Na2CO3质量分数的是
| A.取a克混合物与足量稀硫酸充分反应,逸出气体用碱石灰吸收,增重b克 |
| B.取a克混合物与足量稀盐酸充分反应,加热、蒸干、灼烧,得b克固体 |
| C.取a克混合物充分加热,得b克固体 |
| D.取a克混合物与足量Ca(OH)2溶液充分反应,过滤、洗涤、烘干,得b克固体 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
Al、Cu都是重要的金属元素。下列说法正确的是
| A.两者对应的氧化物均为碱性氧化物 |
| B.两者的单质都能与稀硫酸反应产生氢气 |
| C.常温条件下,两种金属都能溶解于浓硝酸中 |
| D.用惰性电极电解AlCl3、CuCl2的水溶液均可得到氯气 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
工业上用含有铝、铁、铜的废弃合金为主要原料制取硫酸铝溶液、硝酸铜晶体和无水氯化铁,其生产流程如下图所示。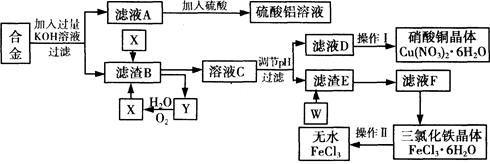
已知:调节适当PH范围可使Fe3+沉淀完全而Cu2+不会沉淀。
请回答下列问题:
(1)写出向合金中加入KOH溶液后所发生反应的离子方程式: 。
(2)在滤液A中直接加入硫酸后所得到的硫酸铝溶液中除含少量硫酸外,还一定含有的杂质是
(填化学式)。
请设计一个更合理的实验方案由滤液A制备纯净的硫酸铝溶液,仿照上图形式画出制备流程图(提示:在箭头上下方标出所用试剂和实验操作) 。
(3) 写出试剂X的名称 。
(4) 实验操作I的顺序依次为 (选填序号)。
| A.蒸馏 | B.蒸发浓缩 | C.过滤 | D.冷却结晶 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(10分)下表为元素周期表的—部分,请参照元素①一⑨在表中的位置,回答下列问题。
(1)第三周期中元素非金属性最强的元素的原子结构示意图是___________。
(2)②③⑦最高价氧化物对应水化物酸性由强到弱的顺序是___________(填化学式)。
(3)用电子式表示⑨的氢化物的形成过程:_________________________________。
(4)下列可以判断⑤和⑥金属性强弱的是______________________(填序号)。
A.单质的熔点⑤比⑥低 B.化合价⑤比⑥低
C.单质与水反应⑤比⑥剧烈 D.最高价氧化物的水化物的碱性⑤比⑥强
(5)含有上述元素的物质间存在以下转化: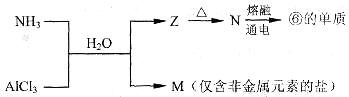
A.M的化学式是___________。
B.N生成⑥的单质反应的化学方程式是_________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
工业上由黄铜矿(主要成分CuFeS2)冶炼铜的主要流程如下: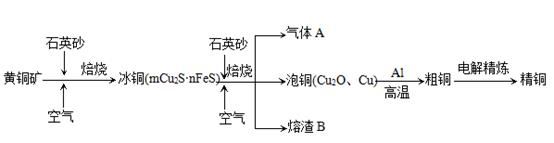
(1)气体A中的大气污染物可选用下列试剂中的_______
a.浓H2SO4 b.稀HNO3 c.NaOH溶液 d.氨水
(2)用稀H2SO4浸泡熔渣B,取少量所得溶液,滴加KSCN溶液后呈红色,说明溶液中存在 (填离子符号),检验溶液中还存在Fe2+的方法是 (注明试剂、现象)。
(3)由泡铜冶炼粗铜的化学反应方程式为 。
(4)以CuSO4溶液为电解质溶液进行粗铜(含Al、Zn、Ag、Pt、Au等杂质)的电解精炼,下列说法正确的是 。
a.电能全部转化为化学能
b.粗铜接电源正极,发生氧化反应
c.溶液中Cu2+向阳极移动
d.利用阳极泥可回收Ag、Pt、Au等金属
(5)利用反应2Cu+O2+2H2SO4=2CuSO4+2H2O可制备CuSO4,若将该反应设计为原电池,其正极电极反应式为 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com