
| A. | 0.2 mol•L-1 NH4Cl和0.1 mol•L-1 NaOH溶液等体积混合后:c(NH4+)>c(Cl-)>c(Na+)>c(OH-)>c(H+) | |
| B. | CuSO4•(NH4)2SO4•6H2O的溶液中:c(SO42-)>c(NH4+)>c(Cu2+)>c(H+)>c(OH-) | |
| C. | 向醋酸钠溶液中加入醋酸至溶液呈酸性:c(CH3COO-)>c(Na+)>c(H+)>c(OH-) | |
| D. | 0.1 mol•L-1 Na2C2O4溶液与0.1 mol•L-1 HCl溶液等体积混合(H2C2O4为二元弱酸):2c(C2O42-)+c(HC2O4-)+c(OH-)=c(H+)+c (Cl-) |
分析 A.0.2mol/L NH4Cl和0.lmol/LNaOH溶液等体积混合,反应生成0.05mol/LNaCl、0.05mol/LNH3•H2O,还剩余0.05mol/LNH4Cl;
B.铜离子和铵根离子部分水解,溶液呈酸性,则c(SO42-)>c(NH4+)>c(Cu2+)、c(H+)>c(OH-);
C.溶液呈酸性,则c(H+)>c(OH-),结合电荷守恒判断;
D.反应后溶质为NaHC2O4,根据NaHC2O4溶液中的电荷守恒判断.
解答 解:A.0.2mol/L NH4Cl和0.1mol/LNaOH溶液等体积混合,反应生成0.05mol/LNaCl、0.05mol/LNH3•H2O,还剩余0.05mol/LNH4Cl,一水合氨的电离程度大于铵根离子的水解程度,溶液显碱性,由溶质的浓度可知氯离子的浓度最大,则c(Cl-)>c(NH4+)>c(Na+)>c(OH-)>c(H+),故A错误;
B.CuSO4•(NH4)2SO4•6H2O的溶液中,铜离子和铵根离子部分水解,溶液呈酸性,则c(SO42-)>c(NH4+)>c(Cu2+)、c(H+)>c(OH-),溶液中离子浓度大小为:c(SO42-)>c(NH4+)>c(Cu2+)>c(H+)>c(OH-),故B正确;
C.向醋酸钠溶液中加入醋酸至溶液呈酸性,则c(H+)>c(OH-),根据电荷守恒可知:c(CH3COO-)>c(Na+),溶液中离子浓度大小为:c(CH3COO-)>c(Na+)>c(H+)>c(OH-),故C正确;
D.0.1 mol•L-1 Na2C2O4溶液与0.1 mol•L-1 HCl溶液等体积混合(H2C2O4为二元弱酸),两溶液恰好反应生成NaHC2O4,根据NaHC2O4溶液中的电荷守恒可知:2c(C2O42-)+c(HC2O4-)+c(OH-)=c(H+)+c (Cl-),故D正确;
故选A.
点评 本题考查离子浓度大小的比较,难度中等,熟悉酸的强弱与盐的水解的关系,电荷守恒、水解与电离的程度及相互影响是解答本题的关键.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源:2017届贵州省高三上第四次模拟化学试卷(解析版) 题型:实验题
以硅藻土为载体的五氧化二钒(V2O5)是接触法生成硫酸的催化剂。从废钒催化剂中回收V2O5既避免污染环境又有利于资源综合利用。废钒催化剂的主要成分为:
物质 | V2O5 | V2O4 | K2SO4 | SiO2 | Fe2O3 | Al2O3 |
| 2.2〜2.9 | 2.8 | 22〜28 | 60〜65 | 1~2 | <1 |
以下是一种废钒催化剂回收工艺路线:
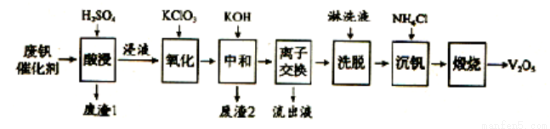
(1) “酸浸”时V2O5转化为VO2+,反应的离子方程式为 ,同时V2O4转成VO2+,“废渣1”的主要成分是 。
(2)“氧化”中欲使3 mol的VO2+变为VO2+,则需要氧化剂KClO3至少为 mol。
(3)“中和”作用之一是使钒以V4O124-形式存在于溶液中。“废渣2”中含有 。
(4)“离子交换”和“洗脱”可简单表示为:4R0H+ V4 0124-
0124-  R4V4O12+4OH-(以ROH为强碱性阴离子交换树脂)。为了提高洗脱效率,淋洗液应该呈 性 (填“酸”“碱”“中”);“流出液”中阳离子最多的是 。
R4V4O12+4OH-(以ROH为强碱性阴离子交换树脂)。为了提高洗脱效率,淋洗液应该呈 性 (填“酸”“碱”“中”);“流出液”中阳离子最多的是 。
(5)“沉钒”得到偏钒酸铵(NH4VO3)沉淀,写出“煅烧”中发生反应的化学方程式 。
查看答案和解析>>
科目:高中化学 来源:2016-2017学年四川省高二上第一次月考化学卷(解析版) 题型:填空题
A、B、C、D、E、F、G是前四周期(除稀有气体)原子序数依次增大的七种元素,A的原子核外电子只有一种运动状态;B、C的价电子层中未成对电子数都是2;B、C、D同周期;E核外的s、p能级的电子总数相筹;F与E同周期且第一电离能比E小;G的+1价离子(G+)的各层电子全充满。回答下列问题:(相关问题用元素符号表示)
(1)写出E的基态原子的电子排布式________________________。
(2)B与C可形成化合物BC和BC2,BC2属于__________(填“极性”、“非极性”)分子,1 mol BC含有π键为____________________mol。
(3)由元素A、C、G组成的离子[G(A2C)4]2+在水溶液中显天蓝色,不考虑空间结构,[G(A2C)4]2+的结构可用示意图表示为__________(配位键用→标出)。
(4)测定A、D形成的化合物的相对分子质量时,实验测定值一般高于理论值的原因是_______。
(5)由元素A、B、F组成的原子个数比9 : 3 : 1的一种物质,分子中含三个相同的原子团,其结构简式为________________,分子中F原子的杂化方式为__________,该物质遇水爆炸,生成白色沉淀和无色气体,反应的化学方程式为____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 消除制硝酸工业尾气中的氮氧化物的污染:NO+NO2+2NaOH═2NaNO2+H2O | |
| B. | 消除硫酸厂尾气中的SO2:SO2+2NH3•H2O═(NH4)2SO3+H2O | |
| C. | 制CuSO4:2Cu+O2$\frac{\underline{\;\;△\;\;}}{\;}$2CuO,CuO+H2SO4(稀)═CuSO4+H2O | |
| D. | 制CuSO4:Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 若某化学反应的反应物总能量高于生成物总能量,则该反应为吸热反应 | |
| B. | 反应2SO2+O2$?_{加热}^{催化剂}$2SO3达平衡后,若升高温度,v(逆)增大,v(正)减小 | |
| C. | 反应2A(g)+B(g)═3C(s)+D(g)在一定条件下能自发进行,说明该反应的△S>0 | |
| D. | 化学上通常认为残留在溶液中的离子浓度小于1×10-5mol/L时,沉淀就达到完全 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 白磷分子的结构如图所示,小球表示磷原子,实线表示共价键,白磷分子中的每个P-P键之间插入一个氧原子后得化合物A,下列关于该化合物A的说法正确的是( )
白磷分子的结构如图所示,小球表示磷原子,实线表示共价键,白磷分子中的每个P-P键之间插入一个氧原子后得化合物A,下列关于该化合物A的说法正确的是( )| A. | 化合物A的分子式为P2O3 | |
| B. | 化合物A是磷酸的酸酐 | |
| C. | 化合物A是磷元素的最高价氧化物 | |
| D. | 化合物A中每个原子最外层都达到8电子的稳定结构 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 硅是光导纤维的主要成分 | |
| B. | 硅钨酸H4SiW12O40中W的化合价为+6 | |
| C. | 二氧化硅与水反应制得的硅酸溶胶有丁达尔效应 | |
| D. | 硅是非金属元素,合金材料中不可能含有硅 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
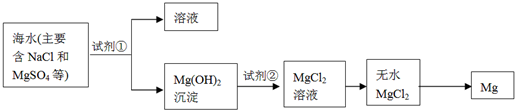
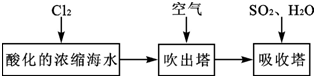
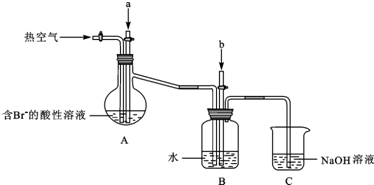
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | C2H2 | B. | C2H4 | C. | C2H6 | D. | C6H6 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com