
 白磷分子的结构如图所示,小球表示磷原子,实线表示共价键,白磷分子中的每个P-P键之间插入一个氧原子后得化合物A,下列关于该化合物A的说法正确的是( )
白磷分子的结构如图所示,小球表示磷原子,实线表示共价键,白磷分子中的每个P-P键之间插入一个氧原子后得化合物A,下列关于该化合物A的说法正确的是( )| A. | 化合物A的分子式为P2O3 | |
| B. | 化合物A是磷酸的酸酐 | |
| C. | 化合物A是磷元素的最高价氧化物 | |
| D. | 化合物A中每个原子最外层都达到8电子的稳定结构 |
分析 (1)一般无机酸直接失去一分子水就形成该酸的酸酐,其酸酐中决定酸性的元素化合价不变.磷酸中磷元素的化合价是+5价,对应的酸酐为P2O5.
(2)一般情况下,原子最外层8电子达到稳定结构.
解答 解:A、如图所示,该结构共有6个P-P键,可插入6个氧原子,因此化合物A的分子式应为P4O6,故A错误;
B、磷酸的酸酐为P2O5,化合物A为P4O6,故B错误;
C、化合物A为P4O6,其中磷元素的化合价为+3价,磷的最高价为+5价,故C错误;
D、在P-O-P键中,磷元素最外层5个电子,氧元素最外层6个电子(两侧与磷各分享3个电子),因此化合物A中每个电子最外层都达到8电子的稳定结构,故D正确.
故选D.
点评 本题主要考察了磷的氧化物,结合原子结构、酸酐等知识,题目较基础,但综合性强,是个不错的题目.


 导学教程高中新课标系列答案
导学教程高中新课标系列答案科目:高中化学 来源:2017届贵州省高三上第四次模拟化学试卷(解析版) 题型:选择题
下列实验中根据现象得出的结论错误的是
选项 | 实验 | 现象 | 结论 |
A | 向NaAlO2溶液中持续通入气体Y | 先出现白色沉淀,最终沉淀又溶解 | Y可能是SO3气体 |
B | 向某溶液中加入Cu 和浓H2SO4 | 试管 | 原溶液可能含有NO3- |
C | 将Na投到一定浓度的CuCl2溶液 | 出现气泡并有固体生成 | Na与CuCl2溶液反应,有H2和Cu生成 |
D | 向浓度均为0.1mol/L的MgCl2、CuCl2混合溶液中逐滴加入氨水 | 先出现蓝色沉淀 | Ksp[Mg(OH)2] >Ksp[Cu(OH)2] |
查看答案和解析>>
科目:高中化学 来源:2016-2017学年四川省高二上第一次月考化学卷(解析版) 题型:选择题
下列说法不正确的是
A.核外电子排布为1s22s22p43s2的原子处于激发态
B.某元素质量数51,中子数28,其基态原子中未成对电子数为1
C.若某基态原子的外围电子排布为4d15s2,该元素原子核外有5个电子层
D.BF3中B原子sp2杂化,为平面三角形
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.2 mol•L-1 NH4Cl和0.1 mol•L-1 NaOH溶液等体积混合后:c(NH4+)>c(Cl-)>c(Na+)>c(OH-)>c(H+) | |
| B. | CuSO4•(NH4)2SO4•6H2O的溶液中:c(SO42-)>c(NH4+)>c(Cu2+)>c(H+)>c(OH-) | |
| C. | 向醋酸钠溶液中加入醋酸至溶液呈酸性:c(CH3COO-)>c(Na+)>c(H+)>c(OH-) | |
| D. | 0.1 mol•L-1 Na2C2O4溶液与0.1 mol•L-1 HCl溶液等体积混合(H2C2O4为二元弱酸):2c(C2O42-)+c(HC2O4-)+c(OH-)=c(H+)+c (Cl-) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
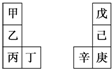 甲~辛等元素在周期表中的相对位置如表所示.甲与戊的原子序数相差3,戊的一种单质是自然界硬度最大的物质,丁和辛属同周期元素.下列判断不正确的是( )
甲~辛等元素在周期表中的相对位置如表所示.甲与戊的原子序数相差3,戊的一种单质是自然界硬度最大的物质,丁和辛属同周期元素.下列判断不正确的是( )| A. | 金属性:甲>乙>丁 | |
| B. | 原子半径:辛>己>戊 | |
| C. | 丙和庚的原子核外电子数相差13 | |
| D. | 乙的单质在空气中燃烧生成离子化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
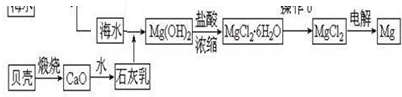
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
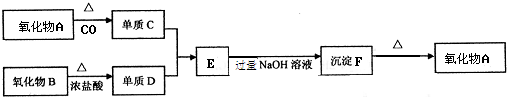
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com