
Fe2O3具有广泛的用途。甲同学阅读有关资料得知:在高温下煅烧FeCO3可以得到Fe2O3。为了进一步验证此结论,他做了如下实验:
| 实验步骤 | 实验操作 |
| Ⅰ | 取一定质量的FeCO3固体置于坩埚中,高温煅烧至质量不再减轻,冷却至室温 |
| Ⅱ | 取少量实验步骤I所得固体放于一洁净的试管中,用足量的稀硫酸溶解 |
| Ⅲ | 向实验步骤Ⅱ所得溶液中滴加KSCN溶液,溶液变红 |
 2Fe2O3+4CO2
2Fe2O3+4CO2(1)Fe3++3SCN-=Fe(SCN)3(写可逆号、络合物形式也合理) (2)c
(3)产物是FeO和Fe2O3的混合物(合理答案均可,既有Fe3+又有Fe2+的组合很多,如FeO和Fe2O3;Fe3O4和FeO;Fe3O4和Fe2O3;FeO、Fe3O4和Fe2O3。)
(4)过氧化氢 过滤 (5)1.16
解析试题分析:(1)煅烧FeCO3可得到Fe2O3,Fe2O3和硫酸反应得到硫酸铁,硫酸铁与KSCN溶液反应生成血红色的硫氰化铁溶液。反应的离子方程式为:Fe3++3SCN-=Fe(SCN)3。(2)亚铁离子与氯水反应变成铁离子,当遇KSCN溶液时产生血红色溶液,而无法同铁离子区分。若用铁氰化钾K3[Fe(CN)6]溶液,它遇到含Fe2+的溶液与反应生成具有特征蓝色的铁氰化亚铁沉淀,离子方程式为:3Fe2+ +2[Fe(CN)6]3-= Fe3[Fe(CN)6]2↓。故选项为:C。(3)只要是产物含有亚铁离子就有乙的现象,如产物是FeO和Fe2O3的混合物或Fe3O4和Fe2O3。等等。(4) 先用硫酸溶解碳酸亚铁得到硫酸亚铁,再用过氧化氢将其氧化得到硫酸铁,加入氨水产生氢氧化铁沉淀,再过滤、洗涤、灼烧即得到Fe2O3。(5)亚铁离子与酸性高锰酸钾溶液反应的离子方程式为:5Fe2++MnO4-+8H+=5Fe3++Mn2-+4H2O.结合 FeCO3+H2SO4=FeSO4+ H2O+CO2↑.可得关系式5FeCO3--- MnO4-,根据给定量的关系科求出菱铁矿的质量是1.16g。
考点:考查Fe2+、Fe3+的检验及滴定法测物质含量等的知识。


科目:高中化学 来源: 题型:填空题
工业上利用废铁屑(含少量氧化铝、氧化铁等)生产碱式硫酸铁[Fe(OH)SO4]的工艺流程如下: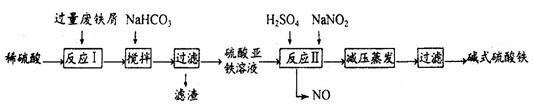
已知:部分阳离子以氢氧化物形式沉淀时溶液的pH如下表:
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Al(OH)3 |
| 开始沉淀 | 2.3 | 7.5 | 3.4 |
| 完全沉淀 | 3.2 | 9.7 | 4.4 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
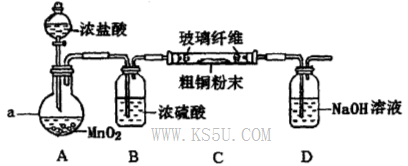
氯化铜是一种广泛用于生产颜料、用木材防腐剂的化工产品。某研究性学习小组用粗铜(含杂质Fe)按下述流程制备氯化铜晶体。
(1)固体A用稀盐酸溶解而不用水溶解的原因是________。
(2)加试剂X用于调节pH以除去杂质,X可选用下列试剂中的____(填序号)。
| A.NaOH | B.NH3.H2O | C.CuO | D.Cu(OH)2E. CuSO4 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
甲、乙两同学在实验室分别取用不同试剂来制取Al(OH)3【可选试剂有:AlCl3溶液、A12(SO4)3溶液、NaOH溶液、氨水】。
(1)请完成下表:
| | 甲同学 | 乙同学 |
| 选用试剂 | A1C13溶液、NaOH溶液 | A12(SO4)3溶液、氨水 |
| 操作 | 向AlCl3溶液中逐滴加入NaOH溶液至过量 | 向A12(SO4)3溶液中逐滴加入氨水至过量 |
| 实验现象 | | |
| 化学方程式 | | A12(SO4)3+6NH3·H2O=2A1(OH)3 ↓+3(NH4)2SO4 |
| 离子方程式 | | |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
活性Fe3O4为黑色固体,有磁性,其不溶于水、碱和酒精、乙醚等有机溶剂中, Fe3O4在潮湿的空气中或高温下易被O2氧化。工业上利用锈蚀废铁为原料,利用共沉淀法制备活性Fe3O4(或写为FeO·Fe2O3)的流程如下:
(1)在制备过程中将块状固体原料粉碎磨成粉末,作用是 。
(2)设计合理的实验方案证明Fe3O4与盐酸反应的产物中含有Fe2+、Fe3+,简述实验操作步骤和实验现象 。
(可供选择的试剂:KSCN溶液、还原铁粉、氯水、酸性高锰酸钾溶液)
(3)假如在反应池中几乎没有气体产生,在合成池里所有铁元素转化为Fe3O4,则根据相关反应可知,配料中心很可能使混合物中的Fe2O3与Fe物质的量之比接近于 。
(4)在一次制备Fe3O4的实验中,由于配料中心反应物比例控制不当,获得了另一种产品FexOy。取一定量该产品溶于足量盐酸中,还需通入标准状况下224 mLCl2才能把溶液中的Fe2+全部氧化为Fe3+,然后把所得溶液滴加足量NaOH溶液,将沉淀过滤、洗涤、蒸干,灼烧至恒重,得8 g固体。计算该产品的化学式。(请写出计算过程)
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
某工厂的废金属屑中主要成分为Cu、Fe和Al,此外还含有少量Al2O3和Fe2O3,该厂用上述废金属屑制取新型高效水处理剂Na2FeO4(高铁酸钠)等产品,过程如下:
I.向废金属屑中加入过量的NaOH溶液,充分反应后过滤;
II.向I所得固体中加入过量稀H2SO4,充分反应后过滤;
III.向II所得固体中继续加入热的稀H2SO4,同时不断鼓入空气,固体溶解得CuSO4溶液;
IV.(1)步骤I中发生反应的化学方程式为 、 。
(2)步骤II所得的滤液中加入KSCN溶液无明显现象,表明滤液中不存在Fe3+,用离子方程式解释其
可能的原因 。
(3)步骤III获得CuSO4溶液的离子方程式为 。
(4)步骤II所得滤液经进一步处理可制得Na2FeO4,流程如下:
①测得滤液中c(Fe2+) 为a mol·L-1,若要处理1 m3滤液,理论上需要消耗25 % 的H2O2溶液_________kg
(用含a的代数式表示)。
②写出由Fe(OH)3制取Na2FeO4的化学方程式___________。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
利用废的生铁丝(表面有铁锈)、硫酸铜废液(含硫酸亚铁)和被有机物污染的废铜粉制备硫酸铜晶体。生产过程如下图: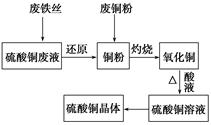
试回答下列问题:
(1)铁丝在投入硫酸铜废液前需用稀H2SO4进行处理,其目的是__________________,可能发生反应的离子方程式有Fe+2H+=Fe2++H2↑、_____________________、__________________。
(2)废铜粉与还原所得铜粉混合灼烧,检验发现灼烧后得到的是CuO和少量Cu的混合物。原因是:
①灼烧不充分Cu未被完全氧化。
②CuO未被还原。还原剂是_______________。
(3)为了使灼烧后的混合物充分酸溶,在加入稀H2SO4的同时,也加入适量的H2O2溶液,并控温在50~60℃,持续反应1h。请回答下列问题:
①反应时温度必须控制在50~60℃,温度不宜过高,这样操作的目的_____;
②写出反应的化学方程式:_____________、________________________________。
(4)由硫酸铜溶液得到硫酸铜晶体的实验操作为________________________。
(5)直接向灼烧后的混合物中加入浓硫酸并加热进行酸溶,也可达到充分酸溶的目的,但实际操作中较少使用,原因可能是_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
ZnO具有抗菌性,也是重要的轮胎添加剂。工业上由粗ZnO(含FeO、CuO)制备活性ZnO流程如下: 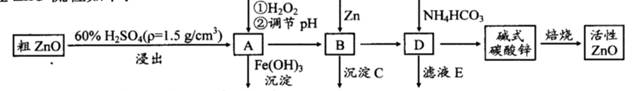
已知此溶液中Fe2+、Fe3+、Cu2+、Zn2+形成氢氧化物的pH如下表:
| 离子 | 开始沉淀的pH | 完全沉淀的pH |
| Fe2+ | 6.4 | 8.4 |
| Fe3+ | 2.4 | 3.1 |
| Cu2+ | 5.2 | 6.7 |
| Zn2+ | 6.8 | 9 |
查看答案和解析>>
科目:高中化学 来源: 题型:问答题
(13分)某种电池的正极材料,可通过下列方法制得:
①称取一定量的固体铁氧体磁性材料溶于过量盐酸,接着先后加入双氧水和氢氧化钠溶液,静置24 h,过滤
②将沉淀加入反应瓶中,加入过量的氢氟酸溶液,80'c恒温加热24 ha
③蒸发多余氢氟酸和水,得淡红色FeF3凝胶
④在干燥箱中,以1000C预处理6 h,最后掺入铁氧体磁性材料混合研磨制得正极材料
(1)加入双氧水的作用是___(用离子方程式表示)
(2)步骤②的反应瓶材质可能是___(填序号)
A.玻璃 B.陶瓷 C.聚四氟乙烯
(3)加氢氟酸反生反应的化学方程式为____
(4)从安全的角度考虑,在实验室里制三氟化铁时应在____中进行
(5)三氟化铁与Li在固体电解质铁氧体中发生置换反应,产生的电流可供电脑使用,该电池反
应的化学方程式为____
(6)取上述铁氧体样品溶于足量盐酸,在通入标准状况下672 mL C12, Fe2+恰好被完全氧化成
Fe3十,然后把溶液蒸干,灼烧至恒重得9.6 g固体,则该铁氧体的化学式为____。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com