
甲、乙两同学在实验室分别取用不同试剂来制取Al(OH)3【可选试剂有:AlCl3溶液、A12(SO4)3溶液、NaOH溶液、氨水】。
(1)请完成下表:
| | 甲同学 | 乙同学 |
| 选用试剂 | A1C13溶液、NaOH溶液 | A12(SO4)3溶液、氨水 |
| 操作 | 向AlCl3溶液中逐滴加入NaOH溶液至过量 | 向A12(SO4)3溶液中逐滴加入氨水至过量 |
| 实验现象 | | |
| 化学方程式 | | A12(SO4)3+6NH3·H2O=2A1(OH)3 ↓+3(NH4)2SO4 |
| 离子方程式 | | |
(1)实验现象:甲 先产生白色沉淀,然后沉淀逐渐消失。乙 产生白色沉淀,沉淀不溶解。化学方程式: 甲 AlCl3+3NaOH=Al(OH)3↓+3NaCl Al(OH)3+NaOH=NaAlO2+2H2O 离子方程式:甲 Al3++3OH-=Al(OH)3↓ Al(OH)3+OH-=AlO2-+2H2O 乙 Al3++3NH3·H2O=Al(OH)3↓+3NH4+
(2)氯化铝溶液和氨水或硝酸铝溶液和氨水。(3)a实验室制取氢氧化铝最好选用可溶性铝盐和氨水。B氢氧化铝可以和氢氧化钠溶液发生反应。
解析试题分析:氢氧化铝是两性氢氧化物,白色絮状物质。既能与强酸反应生成盐和水,也能与强碱反应生成盐和水。所以在实验室制取氢氧化铝时一般用可溶性铝盐与弱碱如一水合氨发生反应制取。制取方法及反应的相应的化学方程式见答案。
考点:考查氢氧化铝的制法与性质的知识 。


科目:高中化学 来源: 题型:填空题
某工厂排放的工业废水中含Fe3+、A13+、Cu2+,工厂为了减少环境污染,变废为宝,利用废铁屑和其它化学试剂进行如下操作,得到了铁红、A12O3和金属Cu。
(1)固体A的成分是 。
(2)写出B→D的离子方程式 。
(3)溶液E焰色反应呈黄色,试剂H是 (填化学式)。
(4)写出D→F反应的离子方程式 。
(5)分别写出铁红和氧化铝在工业上的一种主要用途:铁红 ,氧化铝 。
(6)将溶液E转化为A12O3,请设计一个最合理的方案 (用文字表述)。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
工业上常用铁质容器盛装冷浓硫酸。为研究铁质材料与热浓硫酸的反应,某学习小组进行了以下探究活动:
(1)将已去除表面氧化物的铁钉(碳素钢)放入冷浓硫酸中,10分钟后移入硫酸铜溶液中,片刻后取出观察,铁钉表面无明显变化,其原因是 。
(2)另称取铁钉6.0g放入15.0ml浓硫酸中,加热,充分应后得到溶液X并收集到气体Y。
①甲同学认为X中除Fe3+外还可能含有Fe2+,若要确认其中的Fe2+,应选用 (选填序号)。
a.KSCN溶液和氯水 b.NaOH溶液
c.浓氨水 d.酸性KMnO4溶液
②乙同学取336ml(标准状况)气体Y通入足量溴水中,发生反应:
SO2+Br2+2H2O=2HBr+H2SO4然后加入足量BaCl2溶液,经适当操作后得干燥固体2.33g。由此推知气体Y中SO2的体积分数为 。
分析上述实验中SO2体积分数的结果,丙同学认为气体Y中还可能含有H2和Q气体。为此设计了下列探究实验装置(图中夹持仪器省略)。
(3)装置B中试剂的作用是 。
(4)认为气体Y中还含有Q的理由是 (用化学方程式表示)。
(5)为确认Q的存在,需在装置中添加M于 (选填序号)。
a.A之前 b.A-B间 c.B-C间 d.C-D间
(6)如果气体Y中含有 ,预计实验现象应是 。
,预计实验现象应是 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
从辉铜矿(Cu2S)中利用火法炼铜可以提取铜,发生如下反应:
下面是由Cu2S冶炼铜及制取CuSO4·5H2O的流程图:
⑴Cu2S中铜元素的化合价为 ,当有1molCu2S与O2反应生成2molCu时,转移电子的物质的量是 。
⑵Cu2O、CuO中加入足量稀硫酸得到的体系A中看到溶液呈蓝色,且有红色物质生成,请写出生成红色物质的离子方程式 。
⑶若使A中单质溶解,操作Ⅰ中加入的试剂最好是 。(选填字母代号)
A.适量的HNO3 B.适量的NaOH C.适量的H2O2
该反应的离子方程式为 。
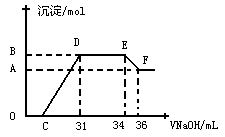
⑷取5.00 g胆矾样品逐渐升高温度使其分解,分解过程的热重曲线(样品质量随温度变化的曲线)如下图所示:
①由图中可以看出,胆矾分解的最低温度是 。
②通过计算确定258℃时发生反应的化学方程式为 ,e点对应的化学式为 (计算过程略去)。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
用含有A12O3、SiO2和少量FeO·xFe2O3的铝灰制备A12(SO4)3·18H2O。,工艺流程如下(部分操作和条件略):
Ⅰ.向铝灰中加入过量稀H2SO4,过滤;
Ⅱ.向滤液中加入过量KMnO4溶液,调节溶液的pH约为3;
Ⅲ.加热,产生大量棕色沉淀,静置,上层溶液呈紫红色;
Ⅳ.加入MnSO4至紫红色消失,过滤;
Ⅴ.浓缩、结晶、分离,得到产品。
H2SO4溶解A12O3的离子方程式是
将KMnO4 氧化Fe2+的离子方程式补充完整: MnO4-+□Fe2++□ =
MnO4-+□Fe2++□ = Mn2++□Fe3+ +□
Mn2++□Fe3+ +□
上式中氧化剂是 ,氧化产物是 。
(3)已知:生成氢氧化物沉淀的pH ks5u
| | Al(OH)3 | Fe(OH)2 | Fe(OH)3 |
| 开始沉淀时 | 3.4 | 6.3 | 1.5 |
| 完全沉淀时 | 4.7 | 8.3 | 2.8 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
某研究性学习小组对铝热反应实验展开研究。现行高中化学教材中对“铝热反应”的现象有这样的描述:“反应放出大量的热,并发出耀眼的光芒”、“纸漏斗的下部被烧穿,有熔融物落入沙中”。查阅《化学手册》知,Al、Al2O3、Fe、Fe2O3熔点、沸点数据如下:
| 物质 | Al | Al2O3 | Fe | Fe2O3 |
| 熔点/℃ | 660 | 2054 | 1535 | 1462 |
| 沸点/℃ | 2467 | 2980 | 2750 | -- |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
Fe2O3具有广泛的用途。甲同学阅读有关资料得知:在高温下煅烧FeCO3可以得到Fe2O3。为了进一步验证此结论,他做了如下实验:
| 实验步骤 | 实验操作 |
| Ⅰ | 取一定质量的FeCO3固体置于坩埚中,高温煅烧至质量不再减轻,冷却至室温 |
| Ⅱ | 取少量实验步骤I所得固体放于一洁净的试管中,用足量的稀硫酸溶解 |
| Ⅲ | 向实验步骤Ⅱ所得溶液中滴加KSCN溶液,溶液变红 |
 2Fe2O3+4CO2
2Fe2O3+4CO2查看答案和解析>>
科目:高中化学 来源: 题型:填空题
铝是一种应用广泛的金属,工业上用Al2O3和冰晶石(Na3AlF6)混合熔融电解制得。铝土矿的主要成分是Al2O3和SiO2及其它不溶于NaOH溶液的杂质。从铝土矿中提炼Al2O3的流程如下:
回答下列问题:
(1)写出反应1的化学方程式 ;
(2)滤液Ⅰ中加入CaO生成的沉淀是 ,反应2的离子方程式为 ;
(3)电解制铝的化学方程式是 ,以石墨为电极,阳极产生的混合气体的成分是 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
甲、乙、丙三种物质之间有如下转化关系: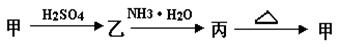
(1)若甲是不溶于水的白色固体物质,既能溶于盐酸又能溶于氢氧化钠溶液,则甲是_______ 。写出乙 丙转化的离子方程式 :________________________ 。
丙转化的离子方程式 :________________________ 。
(2)若乙溶液中加入KSCN溶液 ,有血红色出现,则甲物质是__________,乙物质的水溶液显 性(“酸”或“碱”),原因是 (用离子方程式表示)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com