
某工厂排放的工业废水中含Fe3+、A13+、Cu2+,工厂为了减少环境污染,变废为宝,利用废铁屑和其它化学试剂进行如下操作,得到了铁红、A12O3和金属Cu。
(1)固体A的成分是 。
(2)写出B→D的离子方程式 。
(3)溶液E焰色反应呈黄色,试剂H是 (填化学式)。
(4)写出D→F反应的离子方程式 。
(5)分别写出铁红和氧化铝在工业上的一种主要用途:铁红 ,氧化铝 。
(6)将溶液E转化为A12O3,请设计一个最合理的方案 (用文字表述)。
(1)Fe、Cu(共2分:答对1个给1分,答错一个不给分)
(2)2Fe2++Cl2=2Fe3++2Cl-(共2分)
(3)NaOH(共1分)
(4)Fe3++3OH-=Fe(OH)3↓(共2分)
(5)用作红色油漆和涂料 制造耐火坩埚等(共2分,答案合理即给分)
(6)在溶液E中通入过量的CO2,经过滤和洗涤后,加热固体即得Al2O3。(共1分;答到“加酸”给0.5分,答到“加热固体”给0.5分)
解析试题分析:(1)Fe+2Fe3+=3Fe2+,Fe+Cu2+=Fe2++Cu,由于铁屑过量,则固体A由Fe、Cu组成;B溶液所含金属阳离子为Fe2+、A13+,固体C为目标产物之一的Cu;G为稀硫酸或稀盐酸;(2)氯水是强氧化剂,将Fe2+氧化为Fe3+,即2Fe2++Cl2=2Fe3++2Cl-;D溶液所含金属阳离子为Fe3+、A13+;(3)由目标产物逆推,E为NaAlO2溶液,F为Fe(OH)3,则H为NaOH;(4)Fe3+与OH—反应生成Fe(OH)3沉淀,即Fe3++3OH-=Fe(OH)3↓;(5)铁红常用作炼铁原料、红色油漆和涂料,氧化铝常用作炼铝原料、制造耐火坩埚等;(6)先将AlO2-转化为Al(OH)3沉淀,即AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-或3AlO2-+Al3++6H2O=4Al(OH)3↓;再过滤、洗涤,最后灼烧滤渣,使Al(OH)3分解生成Al2O3和H2O。
考点:考查钠铝铁铜等金属元素及其化合物、混合物的分离和提纯实验等相关知识。


 同步练习强化拓展系列答案
同步练习强化拓展系列答案科目:高中化学 来源: 题型:填空题
室温下,单质A、B、C分别为固体、黄绿色气体、无色气体。在合适的反应条件下,它们可以按下面框图进行反应,又知E溶液是无色的。请回答: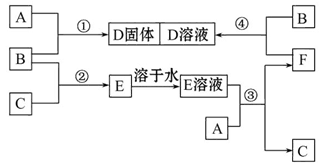
(1)A是_______、B是_______、C是_______ (请填化学式)。
(2)反应①的化学方程式为: ___________________________________。
(3)反应③的离子方程式为: _________________________________________。
(4)反应④的离子方程式为:___________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
电子工业常用30%的FeCl3溶液腐蚀敷在绝缘板上的铜箔,制造印刷电路板。
(1)FeCl3溶液与金属铜发生反应的离子方程式是 。
(2)检验溶液中Fe3+存在的操作步骤和现象是 。
(3)某工程师为了从使用过的腐蚀废液中回收铜,并重新获得氯化铁溶液,准备采用下列步骤: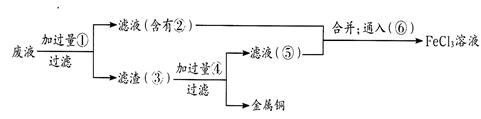
上述实验中加入或生成的有关物质的化学式为② ④____________
通入⑥得到FeCl3溶液的离子反应方程式为________________。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
工业上用某矿渣(含有Cu2O、Al2O3、Fe2O3、SiO2)提取铜的操作流程如下: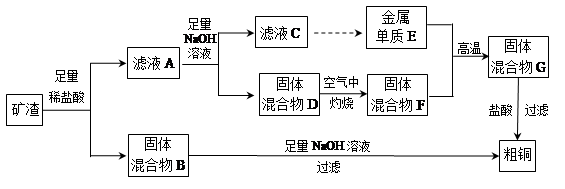
已知:Cu2O+2H+═Cu+Cu2++H2O
(1)固体混合物B与氢氧化钠溶液反应的化学方程式为 。
(2)滤液A中铁元素的存在形式只能为Fe2+,理由是
。涉及的离子方程式为 、
(不必书写Cu2O与盐酸的反应)。检验滤液A中Fe2+的试剂为 (填试剂名称)。
(3)将滤液C中的铝元素以沉淀形式析出,可选用的最佳试剂为 __ (填序号)。
| A.氢氧化钠溶液 | B.硫酸溶液 | C.氨水 | D.二氧化碳 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
某课题组研究以硫铁矿(主要成分为FeS2)为原料制备氯化铁晶体(FeCl3·6H2O)的工艺,其设计的流程如下: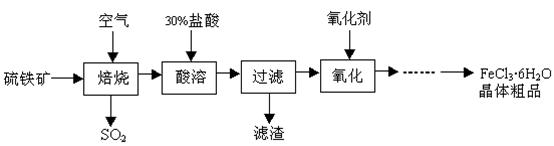
回答下列问题:
(1)已知在焙烧硫铁矿石过程中铁元素转化成了Fe3O4,则该反应的化学方程式 ;
(2)“酸溶”中反应的离子方程式为 ;
(3)“过滤”后滤液中金属阳离子有 ;
(4)“氧化”中使用的氧化剂最好是 ;
(5)该工艺流程中产生的SO2会污染空气并形成酸雨,下列物质:①BaCl2②品红③石灰乳 ④O2,用于吸收SO2最好的是 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
金属铜不溶于稀硫酸,但可溶于铁盐溶液。现将一定量的铜片加入到100 mL稀硫酸和硫酸铁的混合溶液中,铜片完全溶解(不考虑盐的水解及溶液体积的变化)。
(1)写出铜溶解于上述混合溶液的离子方程式_______________________________________。
(2)若铜完全溶解时,溶液中的Fe3+、Cu2+、H+三种离子的物质的量浓度相等,且测得溶液的pH=1,则溶解铜的质量是_________g,溶液中的c(SO42—)=__________mol/L。
(3)若欲在如图所示的装置中发生(1)中的反应,则:X极是 (正、负极),电极反应式 。Y极的材料是 ,电极反应式 。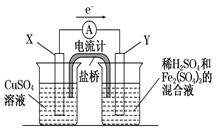
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
工业上利用废铁屑(含少量氧化铝、氧化铁等)生产碱式硫酸铁[Fe(OH)SO4]的工艺流程如下: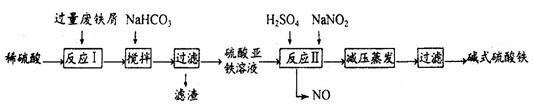
已知:部分阳离子以氢氧化物形式沉淀时溶液的pH如下表:
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Al(OH)3 |
| 开始沉淀 | 2.3 | 7.5 | 3.4 |
| 完全沉淀 | 3.2 | 9.7 | 4.4 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
从铝土矿(主要成分是Al2O3,含SiO2、Fe2O3、MgO等杂质)中提取两种工艺的流程如下: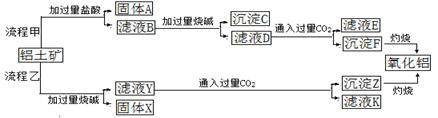
请回答下列问题:
(1)流程甲加入盐酸后生成Al3+的方程式为____________________________.
(2)流程乙加入烧碱后生成SiO32—的离子方程式为______________________.
(3)验证滤液B含Fe3+,可取少量滤液并加入________(填试剂名称)。
(4)滤液E、K中溶质的主要成份是____________(填化学式),写出该溶液的一种用途____________
(5)已知298K时,Mg(OH)2的溶度积常数KSP=5.6×10—12,取适量的滤液B,加入一定量的烧碱达到沉淀溶液平衡,测得PH=13.00,则此温度下残留在溶液中的c(Mg2+)=__________________.
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
甲、乙两同学在实验室分别取用不同试剂来制取Al(OH)3【可选试剂有:AlCl3溶液、A12(SO4)3溶液、NaOH溶液、氨水】。
(1)请完成下表:
| | 甲同学 | 乙同学 |
| 选用试剂 | A1C13溶液、NaOH溶液 | A12(SO4)3溶液、氨水 |
| 操作 | 向AlCl3溶液中逐滴加入NaOH溶液至过量 | 向A12(SO4)3溶液中逐滴加入氨水至过量 |
| 实验现象 | | |
| 化学方程式 | | A12(SO4)3+6NH3·H2O=2A1(OH)3 ↓+3(NH4)2SO4 |
| 离子方程式 | | |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com