
电子工业常用30%的FeCl3溶液腐蚀敷在绝缘板上的铜箔,制造印刷电路板。
(1)FeCl3溶液与金属铜发生反应的离子方程式是 。
(2)检验溶液中Fe3+存在的操作步骤和现象是 。
(3)某工程师为了从使用过的腐蚀废液中回收铜,并重新获得氯化铁溶液,准备采用下列步骤: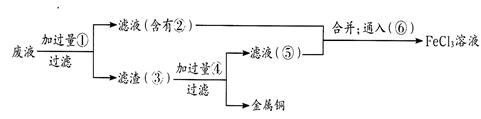
上述实验中加入或生成的有关物质的化学式为② ④____________
通入⑥得到FeCl3溶液的离子反应方程式为________________。
(1)2Fe3++Cu=2Fe2++Cu2+(2)取少许溶液,向其中滴加KSCN溶液,溶液变红色 (其他合理答案同样得分)(3)②FeCl2 ④ HC1 2Fe2++C12=2Fe3++2C1–
解析试题分析:(1)FeCl3溶液与金属铜发生反应生成氯化亚铁和氯化铜,离子方程式是2Fe3++Cu=2Fe2++Cu2+;(2)检验溶液中Fe3+存在通常用KSCN溶液,操作步骤和现象是取少许溶液,向其中滴加KSCN溶液,溶液变红色;(3)反应的废液中含有氯化亚铁、氯化铜,由工艺流程可知,废液中加入过量①铁粉发生反应Fe+Cu2+=Fe2++Cu,过滤得滤液为氯化亚铁溶液,滤渣③为金属铜和铁的混合物,滤渣③加入过量盐酸,发生反应Fe+ 2HC1=FeC12+H2,过滤得金属铜,滤液为氯化亚铁溶液,氯化亚铁溶液中通入氯气发生反应2Fe2++C12=2Fe3++2C1–,可以得到氯化铁。根据上述分析知,②为FeCl2,④为HC1;通入⑥得到FeCl3溶液的离子反应方程式为2Fe2++C12=2Fe3++2C1– 。
考点:考查铁及其化合物的性质。


 黄冈天天练口算题卡系列答案
黄冈天天练口算题卡系列答案科目:高中化学 来源: 题型:填空题
工业上用铝土矿(成分为氧化铝、氧化铁)制取铝的流程如下:
请回答下列问题。
(1)操作Ⅰ、操作Ⅱ、操作Ⅲ都用到的玻璃仪器有________________________________。
(2)写出由溶液B生成Al(OH)3的离子方程式:_________________________________________________________。
(3)工艺流程中涉及氧化还原反应的化学方程式为______________________________________________________________________。
(4)生产过程中,除NaOH、H2O可以循环使用外,还可以循环使用的物质有________(填化学式)。用此法制取铝的副产品是________(填化学式)。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
从含有Ag+、Fe3+和Al3+的溶液中,按下图所示方法分离提取金属单质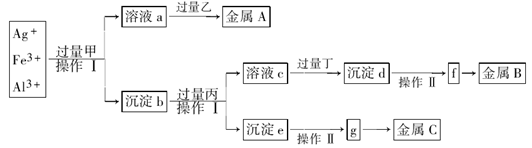
已知:实验时甲、乙、丙、丁四种物质只能从碳酸铵、氢氧化钠、稀硫酸、葡萄糖四种溶液中选择,也可用这四种溶液来制取。对该实验过程的分析正确的是
| A.丙是NaOH,丁是稀H2SO4 |
| B.乙是葡萄糖,利用乙的还原性将金属A从溶液a中还原出来 |
| C.操作I是过滤和洗涤沉淀。洗涤沉淀的方法是将漏斗中的沉淀转移到小烧杯中,加蒸馏水浸没沉淀,用玻璃棒搅拌,然后将水倒出,重复2-3次 |
| D.g是氧化物,金属c采用电解法获得 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
明矾石的主要成分为K2SO4·Al2(SO4)3·2Al2O3·6H2O,此外还含有少量Fe2O3杂质。某校研究小组利用明矾石制备氢氧化铝的流程如下: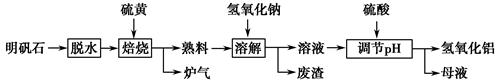
(1)“焙烧”过程中反应的化学方程式为 Al2(SO4)3+
Al2(SO4)3+ S
S
 Al2O3+
Al2O3+ ________↑。
________↑。
(2)分离溶液和废渣的操作是________,“溶解”时反应的离子方程式为_________________________________。
(3)“调节pH”后过滤、洗涤Al(OH)3沉淀,证明沉淀已洗涤干净的实验操作和现象是________。
(4)“母液”中可回收的物质是________。
(5)若“焙烧”过程中恰好消耗48 g硫黄,则理论上最终可得到________ g氢氧化铝。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(13分)某混合物A,含有KAl(SO4)2、Al2O3和Fe2O3,在一定条件下可实现下图所示的物质之间的变化: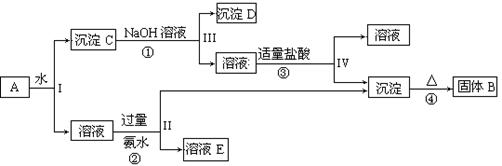
据此回答下列问题:
(1)I、II、III、IV四步中对于溶液和沉淀的分离采取的方法是 。
(2)根据上述框图反应关系,写出下列B、 D所含物质的化学式
固体B ;沉淀D 。
(3)写出①、②反应的离子方程式:
① ;② ;
(4)以Fe2O3为原料,可制备FeCl2溶液,请写出有关的化学反应方程式,试剂任选。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
铁和铁的化合物用途广泛。请回答下列问题:
(1)写出在潮湿空气中钢铁锈蚀时正极反应的电极反应式:_______________________。
将生锈的铁屑放入H2SO4溶液中充分溶解后,在溶液中并未检测出Fe3+,用离子方程式说明原因:______________________________________。
(2)爱迪生蓄电池的反应式为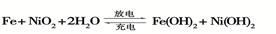
①爱迪生蓄电池的正极是 ,该电池工作一段时间后必须充电,充电时生成Fe的反应类型是______。
②高铁酸钠(Na2FeO4)是一种新型净水剂。用如图装置可以制取少量高铁酸钠。写出在用电解法制取高铁酸钠时,阳极的电极反应式___________________________________。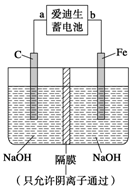
③你认为高铁酸钠作为一种新型净水剂的理由错误的是______。
a.高铁酸钠溶于水形成一种胶体,具有较强的吸附性
b.高铁酸钠在消毒杀菌时被还原生成Fe3+,Fe3+水解产生氢氧化铁胶体能吸附悬浮杂质
c.高铁酸钠具有强氧化性,能消毒杀菌
d.高铁酸钠具有强还原性,能消毒杀菌
(3)某FeO、Fe2O3混合物中,铁、氧的物质的量之比为4︰5,其中Fe2+与Fe3+物质的量之比为___________。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
A、B、C、D、E、F六种物质的焰色反应均为黄色。 A、B、C、D与盐酸反应均生成E,此外B还生成—种可燃性气体;而C、D还生成—种无色无味的气体H,该气体能使澄清的石灰水变浑浊。D和A可反应生成C,F和H也可反应生成C和另—种无色无味气体。
请回答下列问题:
(1)写出B、C的化学式:B:___________________; C:___________________;
(2)写出F和H2O反应的化学方程式:__________________________________;
(3)写出下列反应的离子方程式
①D溶液+盐酸:_____________________________________________________;
②D溶液+A溶液:___________________________________________________;
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
某工厂排放的工业废水中含Fe3+、A13+、Cu2+,工厂为了减少环境污染,变废为宝,利用废铁屑和其它化学试剂进行如下操作,得到了铁红、A12O3和金属Cu。
(1)固体A的成分是 。
(2)写出B→D的离子方程式 。
(3)溶液E焰色反应呈黄色,试剂H是 (填化学式)。
(4)写出D→F反应的离子方程式 。
(5)分别写出铁红和氧化铝在工业上的一种主要用途:铁红 ,氧化铝 。
(6)将溶液E转化为A12O3,请设计一个最合理的方案 (用文字表述)。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
工业上常用铁质容器盛装冷浓硫酸。为研究铁质材料与热浓硫酸的反应,某学习小组进行了以下探究活动:
(1)将已去除表面氧化物的铁钉(碳素钢)放入冷浓硫酸中,10分钟后移入硫酸铜溶液中,片刻后取出观察,铁钉表面无明显变化,其原因是 。
(2)另称取铁钉6.0g放入15.0ml浓硫酸中,加热,充分应后得到溶液X并收集到气体Y。
①甲同学认为X中除Fe3+外还可能含有Fe2+,若要确认其中的Fe2+,应选用 (选填序号)。
a.KSCN溶液和氯水 b.NaOH溶液
c.浓氨水 d.酸性KMnO4溶液
②乙同学取336ml(标准状况)气体Y通入足量溴水中,发生反应:
SO2+Br2+2H2O=2HBr+H2SO4然后加入足量BaCl2溶液,经适当操作后得干燥固体2.33g。由此推知气体Y中SO2的体积分数为 。
分析上述实验中SO2体积分数的结果,丙同学认为气体Y中还可能含有H2和Q气体。为此设计了下列探究实验装置(图中夹持仪器省略)。
(3)装置B中试剂的作用是 。
(4)认为气体Y中还含有Q的理由是 (用化学方程式表示)。
(5)为确认Q的存在,需在装置中添加M于 (选填序号)。
a.A之前 b.A-B间 c.B-C间 d.C-D间
(6)如果气体Y中含有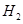 ,预计实验现象应是 。
,预计实验现象应是 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com