
(13分)某混合物A,含有KAl(SO4)2、Al2O3和Fe2O3,在一定条件下可实现下图所示的物质之间的变化: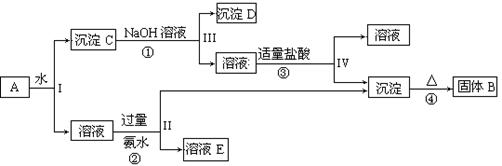
据此回答下列问题:
(1)I、II、III、IV四步中对于溶液和沉淀的分离采取的方法是 。
(2)根据上述框图反应关系,写出下列B、 D所含物质的化学式
固体B ;沉淀D 。
(3)写出①、②反应的离子方程式:
① ;② ;
(4)以Fe2O3为原料,可制备FeCl2溶液,请写出有关的化学反应方程式,试剂任选。
(1)过滤;(2)Al2O3;;Fe2O3;
(3)①Al2O3+2OH- =2AlO2-+H2O (2分)
②Al3++3NH3·H2O=Al(OH) 3↓+3NH4+(2分)
(4)Fe2O3 + 6HCl =" 2" FeCl3 + 3 H2O ;(2分) (其余合理答案也可给分)
2FeCl3 + Fe = 3FeCl2 (2分)
解析试题分析:根据题意知,混合物A含有KAl(SO4)2、Al2O3和Fe2O3,加水后经过滤可得KAl(SO4)2溶液和Al2O3、Fe2O3沉淀混合物C,向混合物C中加入NaOH溶液,NaOH和Al2O3反应生成NaAlO2,过滤后得到NaAlO2溶液,沉淀D为Fe2O3, NaAlO2溶液中加入适量盐酸,反应生成Al(OH)3和NaCl,Al(OH)3加热分解生成B为Al2O3,溶液KAl(SO4)2中通入过量氨气生成氢氧化铝沉淀和溶液E,溶液E为K2SO4和(NH4)2SO4混合物;(1)根据题给流程图知,I、II、III、IV四步为溶液和沉淀的分离,采取的方法是过滤;(2)由以上分析可知B为Al2O3,D为Fe2O3;(3)反应①为Al2O3和氢氧化钠的反应,方程式为Al2O3+2NaOH=2NaAlO2+H2O,反应②为Al3+和氨水的反应,反应的离子方程式为Al3++3NH3、H2O=Al(OH)3↓+3 NH4+;(4)以Fe2O3为原料,可制备FeCl2溶液,可将氧化铁先与盐酸反应,生成氯化铁和水,然后再加入过量铁粉充分反应后过滤即得氯化亚铁溶液,反应方程式为Fe2O3 + 6HCl =" 2" FeCl3 + 3 H2O ;2FeCl3 + Fe = 3FeCl2。
考点:本题以化学工艺流程为载体考查物质的分离提纯及铁、铝及其化合物的性质。


 同步练习河南大学出版社系列答案
同步练习河南大学出版社系列答案 同步练习西南大学出版社系列答案
同步练习西南大学出版社系列答案 补充习题江苏系列答案
补充习题江苏系列答案 学练快车道口算心算速算天天练系列答案
学练快车道口算心算速算天天练系列答案科目:高中化学 来源: 题型:填空题
工业上用某矿渣(含有Cu2O、Al2O3、Fe2O3、SiO2)提取铜的操作流程如下:
已知:Cu2O+2H+=Cu+Cu2++H2O
(1)实验操作Ⅰ的名称为________;在空气中灼烧固体混合物D时,用到多种硅酸盐质的仪器,除玻璃棒、酒精灯、泥三角外,还有________(填仪器名称)。
(2)滤液A中铁元素的存在形式为________(填离子符号),生成该离子的离子方程式为__________________,检验滤液A中存在该离子的试剂为________(填试剂名称)。
(3)金属单质E与固体混合物F发生的某一反应可用于焊接钢轨,该反应的化学方程式为_______________________________________________。
(4)常温下,等pH的NaAlO2和NaOH两份溶液中,由水电离出的c(OH-)前者为后者的108倍。则两种溶液的pH=________。
(5)①利用电解法进行粗铜精炼时,下列叙述正确的是________(填代号)。
a.电能全部转化为化学能
b.粗铜接电源正极,发生氧化反应
c.精铜作阴极,电解后电解液中Cu2+浓度减小
d.粗铜精炼时通过的电量与阴极析出铜的量无确定关系
②从浓硫酸、浓硝酸、蒸馏水中选用合适的试剂,测定粗铜样品中金属铜的质量分数,涉及的主要步骤:称取一定质量的样品→________________→过滤、洗涤、干燥→称量剩余固体铜的质量。(填缺少的操作步骤,不必描述操作过程的细节)
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(14分) 某化学小组模拟“侯氏制碱法”,以NaCl、NH3、CO2和水等为原料以及下图所示装
某化学小组模拟“侯氏制碱法”,以NaCl、NH3、CO2和水等为原料以及下图所示装
置制取NaHCO3,反应的化学方程式为NH3+CO2+H2O+NaCl = NaHCO3↓+NH4Cl。然后再将NaHCO3制成
Na2CO3。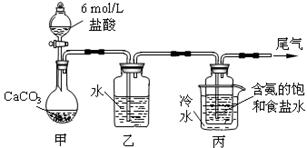
(1)装置乙的作用是 。为防止污染空气,尾气中含有的 需要进行吸收处理。
(2)由装置丙中产生的NaHCO3制取Na2CO3时,需要进行的实验操作有 、 、 。
NaHCO3转化为Na2CO3的化学方程式为 。
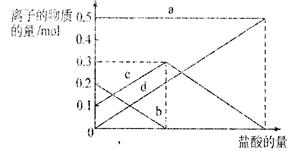
(3)若在(2)中灼烧的时间较短,NaHCO3将分解不完全,该小组对一份加热了t1 min的NaHCO3 样品的组成进行了以下探究。
取加热了t1 min的NaHCO3样品29.6 g完全溶于水制成溶液,然后向此溶液中缓慢地滴加稀盐酸,并不断搅拌。随着盐酸的加入,溶液中有关离子的物质的量的变化如右图所示。
则曲线c对应的溶液中的离子是
(填离子符号);该样品中NaHCO3和Na2CO3的物质的量之比是 。
(4)若取21. 0 g NaHCO3固体,加热了t2 min后,剩余固体的质量为l4.8 g。如果把此剩余固体全部加入到200 mL 2 mol·L-1的盐酸中则充分反应后溶液中H+ 的物质的量浓度为____________(设溶液体积变化忽略不计)。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
下图所示的是一些常见的单质、化合物之间的转化关系图,有些反应中的部分物质和反应条件被略去。化合物A是家庭生活中常用的一种调味品,反应①称之为“氯碱工业”。D是黄绿色气体,H的水溶液具有漂白、杀菌性,J为红褐色沉淀。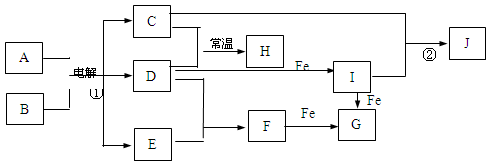
(1)H的化学式为 。
(2)写出I与Fe反应生成G的离子方程式为 。
(3)反应①的化学方程式为 。
(4)反应②的离子方程式为 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
孔雀石主要含Cu2(OH)2CO3,还含少量Fe、Si的化合物。以孔雀石为原料可制备CuSO4·5H2O及纳米材料G,步骤如下: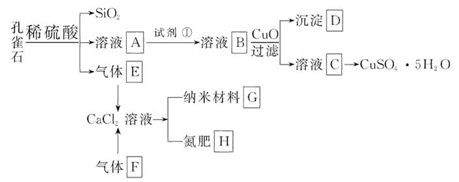
请回答下列问题:
(1)溶液A中的金属离子有Cu2+、Fe2+、Fe3+。从下列所给试剂中选择:实验步骤中,试剂①最佳为_______(填代号)。
a.KMnO4 b.(NH4)2S c.H2O2 d.HNO3
沉淀D中除了过量的CuO外,还存在另一种固体,其化学式为______________。加入CuO的作用是_____________________。
(2)由溶液C获得CuSO4·5H2O,需要经过一系列操作。除烧杯、漏斗外,过滤操作还用到另一玻璃仪器,该仪器在此操作中的主要作用是______________。
(3)制备纳米材料G时,应向CaCl2溶液中先通入(或先加入) _______ (填化学式)。写出该反应的化学方程式_______________________________________。
(4)欲测定溶液A中Fe2+的浓度,可用KMnO4标准溶液滴定,取用KMnO4标准溶液应用_______ (填写仪器名称);取A溶液稀释一定倍数后,用KMnO4标准溶液滴定,终点现象为_______。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
电子工业常用30%的FeCl3溶液腐蚀敷在绝缘板上的铜箔,制造印刷电路板。
(1)FeCl3溶液与金属铜发生反应的离子方程式是 。
(2)检验溶液中Fe3+存在的操作步骤和现象是 。
(3)某工程师为了从使用过的腐蚀废液中回收铜,并重新获得氯化铁溶液,准备采用下列步骤: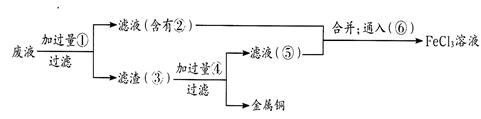
上述实验中加入或生成的有关物质的化学式为② ④____________
通入⑥得到FeCl3溶液的离子反应方程式为________________。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
A、B、C、D、E为中学化学常见的单质或化合物,其相互转化关系如下图所示。
(1)若A是淡黄色化合物;常温下D是无色气体;C中含有的阴、阳离子均为10电子粒子。
①写出反应A→B的化学方程式 ;
②将一定量的气体D通入2 L C的溶液中,向所得溶液中边逐滴加入稀盐酸边振荡至过量,产生的气体与盐酸物质的量的关系如图(忽略气体的溶解和HCl的挥发)。请回答:O点溶液中所含溶质的化学式为 ,a点溶液中各离子浓度由大到小的关系是 。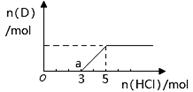
(2)若将(1)中的气体D通入氢氧化钡溶液中得不溶物F,F的KSP=8.1×10-9。现将该沉淀放入0.1mol/L 的BaCl2溶液中,其KSP ,(填:增大、减小或不 变),组成不溶物F的阴离子在溶液中的浓度为 mol/L。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
某课题组研究以硫铁矿(主要成分为FeS2)为原料制备氯化铁晶体(FeCl3·6H2O)的工艺,其设计的流程如下: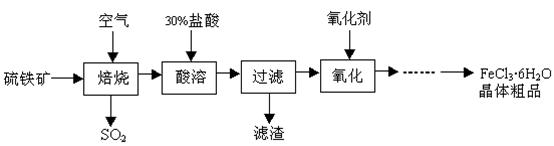
回答下列问题:
(1)已知在焙烧硫铁矿石过程中铁元素转化成了Fe3O4,则该反应的化学方程式 ;
(2)“酸溶”中反应的离子方程式为 ;
(3)“过滤”后滤液中金属阳离子有 ;
(4)“氧化”中使用的氧化剂最好是 ;
(5)该工艺流程中产生的SO2会污染空气并形成酸雨,下列物质:①BaCl2②品红③石灰乳 ④O2,用于吸收SO2最好的是 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
目前,铁是使用最广泛的金属之一,已知在高温下,Fe与水蒸气可发生反应。
应用下列装置,在硬质玻璃管中放入还原铁粉和石棉绒的混合物,加热,并通入水蒸气,就可以完成高温下“Fe与水蒸气的反应实验”。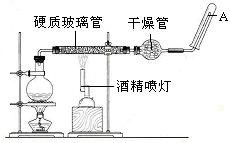
请回答下列的问题。
铁在周期表中的位置是_______
请写出该反应的化学方程式: ;
(3)曾利用铝和铁的氧化物反应原理来焊接钢轨,该反应的化学方程式为
(4)现有铁和铂组成的合金共a mol,其中Pt的物质的量分数为x,研成粉末状后全部投入含bmol HNO3的稀溶液中,使其充分反应,且HNO3的还原产物只有NO。试回答下列问题:
①随HNO3用量的增加,溶液中的金属离子和残留固体的成分依次有四种情况,请用粒子符号填写下表空白:
| | ① | ② | ③ | ④ |
| 溶液中的金属离子 | | Fe2+ | | |
| 残留固体成分 | Fe、Pt | | Pt | Pt |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com