
【题目】四中某学习小组依据氧化还原反应原理:2Ag++Cu=Cu2++2Ag设计成的原电池如右图所示。
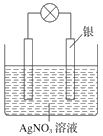
(1) 从能量转化角度分析,上述原电池将化学能转化为_________ ;
(2) 负极的电极材料为_____________;
(3) 正极发生的电极反应__________________________________;
(4) 假设反应初两电极质量相等,当反应进行到一段时间后(AgNO3溶液足量),取出两电极洗净干燥后称量,测得两电极质量差为11.2 g,则该时间内原电池反应转移的电子数为_____________。(设NA表示阿伏加德罗常数的值)
【答案】电能 Cu (或铜) Ag+ + e- = Ag 0.08NA
【解析】
(1)该装置为原电池,原电池将化学能转化为电能;
(2)原电池中活泼金属做负极,不活泼金属做正极,铜的金属活泼性比银强,因此负极的电极材料为铜;
(3)原电池中正极上得电子发生还原反应,据此写出电极反应式为;
(4)正极上的电极反应式为:Ag+ + e- = Ag,负极上的电极反应式为:Cu - 2e-=Cu2+,设转移电子物质的量为xmol,则正极上生成银的质量为xmol×108g/mol=108xg,负极上消耗铜的质量为1/2xmol×64g/mol=32xg,反应后测得两电极质量差为11.2g,据此计算转移的电子数 ;
(1)该装置为原电池,原电池将化学能转化为电能,
故答案为:电能;
(2)铜的金属活泼性比银强,铜失电子生成铜离子,银离子得电子生成银,因此负极的电极材料为铜,
故答案为:铜;
(3)正极上银离子得电子生成银,电极反应式为:Ag+ + e- = Ag,
故答案为:Ag+ + e- = Ag;
(4)正极上的电极反应式为:Ag+ + e- = Ag,负极上的电极反应式为:Cu - 2e-=Cu2+,设转移电子物质的量为xmol,则正极上生成银的质量为xmol×108g/mol=108xg,负极上消耗铜的质量为1/2xmol×64g/mol=32xg,反应后测得两电极质量差为11.2g,则108xg +32xg =11.2g,解得x=0.08mol,该时间内原电池反应转移的电子数为0.08NA,
故答案为:0.08NA ;


科目:高中化学 来源: 题型:
【题目】二氧化氯(ClO2,黄绿色易溶于水的气体)是高效、低毒的消毒剂。回答下列问题:
(1)工业上可用KC1O3与Na2SO3在H2SO4存在下制得ClO2,该反应氧化剂与还原剂物质的量之比为___________________。
(2)实验室用NH4Cl、盐酸、NaClO2(亚氯酸钠)为原料,通过以下过程制备ClO2:
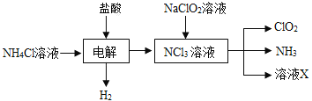
①电解时发生反应的化学方程式为_____________________________________。
②溶液X中大量存在的阴离子有_______________________________________。
③除去ClO2中的NH3可选用的试剂是______(填标号)。
a.水 b.碱石灰 c.浓硫酸 d.饱和食盐水
(3)用下图装置可以测定混合气中ClO2的含量:
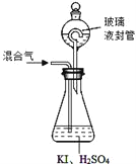
Ⅰ.在锥形瓶中加入足量的碘化钾,用50 mL水溶解后,再加入3 mL稀硫酸;
Ⅱ.在玻璃液封装置中加入水,使液面没过玻璃液封管的管口;
Ⅲ.将一定量的混合气体通入锥形瓶中吸收;
Ⅳ.将玻璃液封装置中的水倒入锥形瓶中;
Ⅴ.用0.1000 mol·L-1硫代硫酸钠标准溶液滴定锥形瓶中的溶液(I2+2S2O32-=2I-+S4O62-),指示剂显示终点时共用去20.00 mL硫代硫酸钠溶液。在此过程中:
①锥形瓶内ClO2与碘化钾反应的离子方程式为_________________________________。
②玻璃液封装置的作用是 ______________。
③V中加入的指示剂通常为__________,滴定至终点的现象是_____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】依据信息书写下列反应的方程式
⑴K2O2可用于潜水设备中作供氧剂,写出K2O2与CO2反应的化学方程式:________。
⑵SO2是一种酸性氧化物,可制取Na2SO3,从括号内所给试剂(NaCl溶液、NaOH溶液、Na2SO4溶液)中选择合适的,完成这一反应,写出该反应的化学方程式:________。
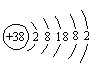
⑶锶(Sr)原子的结构示意图如图所示,锶能与水发生剧烈反应生成碱和氢气,写出单质锶与水反应的化学方程式:________。
⑷MnO2可经过下图所示的转化制取MnCO3。已知“反应Ⅱ”为复分解反应。
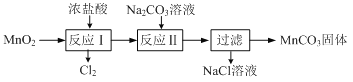
①写出“反应Ⅰ”的化学方程式:________。
②写出“反应Ⅱ”的离子方程式:________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某班学生对BeCl2是离子化合物还是共价化合物进行集体探究,从经验看铍是金属元素,易失去电子,氯元素易得到电子,请回答以下问题:
(1)Be的电负性是1.5,Cl的电负性是3.0,则BeCl2应为_________化合物。
(2)工业上制取BeCl2方法是:将得到的BeCl2溶液在HCl气流中蒸干灼烧,防止BeCl2水解,请写出BeCl2水解的化学方程式__________________。
(3)经实验验证,熔融的BeCl2不能导电,说明它是_______化合物;BeCl2能溶于水,水溶液能导电,因它在溶液中能电离,写出它的电离方程式_________。
(4)在周期表中,铍元素和铝元素恰好处于对角线位置,根据对角线法则,判断BeCl2应与_____(填MgCl2或AlCl3)化学性质更相似。
(5)0.1mol氢氧化铍恰好能和100mL0.2mol/L的氢氧化钠溶液发生反应,写出反应的化学方程式_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在固定容积的密闭容器中,A和B发生下列反应,A(s)+2B(g)![]() 2C(g)△H>0.在一定条件下达到平衡,若升高温度则达平衡后混合气体的
2C(g)△H>0.在一定条件下达到平衡,若升高温度则达平衡后混合气体的
A.平均相对分子质量增大 B.平均相对分子质量减小 C.密度减小 D. 气体压强增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】500 ℃条件下,在恒容密闭容器中,充入1 mol NO2存在如下平衡:2NO2(g) ![]() N2O4(g)。平衡后,向容器内再充入1 mol NO2,下列说法正确的是
N2O4(g)。平衡后,向容器内再充入1 mol NO2,下列说法正确的是
A. 平衡向正反应方向移动 B. 平衡常数K增大
C. NO2的转化率变小 D. 容器内气体颜色先变深后变浅,最后比原来还要浅
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,在一个1L的密闭容器中,加入2molA和1molB进行如下反应:2A(g)+2B(g)![]() 3C(?)+D(?)。反应一段时间后达到平衡,测得生成0.6molC,且反应前后压强之比为15∶11(相同温度下测量),则下列说法正确的是( )
3C(?)+D(?)。反应一段时间后达到平衡,测得生成0.6molC,且反应前后压强之比为15∶11(相同温度下测量),则下列说法正确的是( )
A. 该反应的化学平衡常数K约为0.043
B. 增加C的物质的量,B的平衡转化率不变
C. 增大该体系的压强,平衡正向移动,化学平衡常数增大
D. A的平衡转化率是40%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】雾霾天气严重影响人们的生活,汽车尾气所排放的氮氧化物及燃煤所排放的硫氧化物是造成雾霾的重要原因。
(1)NH3催化还原氮氧化物(SCR)技术是目前应用最广泛的烟气氮氧化物脱除技术。反应原理如图1所示:
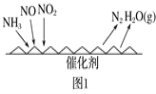
①由图1可知,SCR技术中的氧化剂为___。已知c(NO2)∶c(NO)=1∶4时脱氮效果最佳,此时对应的脱氮反应的化学方程式为__。
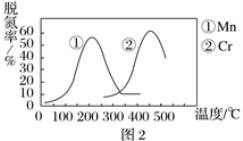
②图2是不同催化剂Mn和Cr在不同温度下对应的脱氮率,由图可知工业使用的最佳的催化剂和相应的温度分别为___。
(2)改善能源结构是治理雾霾问题的最直接有效途径。二甲醚是一种清洁能源,可用合成气在催化剂下制备二甲醚,其反应为:2CO(g)+4H2(g)![]() CH3OCH3 (g)+H2O(g) ΔH。
CH3OCH3 (g)+H2O(g) ΔH。
已知在一定条件下,该反应中CO的平衡转化率α随温度、投料比![]() 的变化曲线如图3所示。
的变化曲线如图3所示。
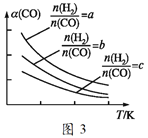
①a、b、c按由大到小的顺序排序为_______;ΔH_______0(填“>”“<”或“=”)。
②对于气相反应,用某组分(B)的平衡分压p(B)代替物质的量浓度c(B)也可以表示平衡常数(记作Kp),则该反应平衡常数的表达式Kp=__。
③在恒容密闭容器里按体积比为1∶2充入一氧化碳和氢气,一定条件下反应达到平衡状态。当改变反应的某一个条件后,下列能说明平衡一定向逆反应方向移动的是______。
A.一氧化碳的转化率减小
B.容器的压强增大
C.化学平衡常数K值减小
D.逆反应速率先增大后减小
E.混合气体的密度增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有14.4 g CO和CO2的混合气体,在标准状况下,其体积为8.96 L。回答下列问题:
(1)该混合气体的平均摩尔质量为________________。
(2)混合气体中碳原子的个数为______________(用NA表示阿伏加德罗常数的值)。
(3)将混合气体依次通过如图所示装置,剩余气体最后收集在气球中(实验在标准状况下测定)。
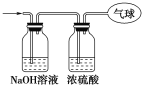
①气球中收集到的气体中,电子总数为________(用NA表示阿伏加德罗常数的值)。
②气球的体积为________L。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com