
【题目】在可逆反应中,改变下列条件一定能加快反应速率的是
A. 增大反应物的量 B. 升高温度 C. 增大压强 D. 减小生成物的量
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】A、B、C、D为前三周期元素。A元素的原子价电子排布为ns2np2,B元素原子的最外层电子数是其电子层数的3倍,C元素原子的M能层的p能级有3个未成对电子,D元素原子核外的M能层中只有2对成对电子。请回答下列问题:
(1)当n = 2时.AB2属于____分子(填“极性”或“非极性”) ,分子中有____个σ键、___个π键。A6H6分子中A原子的杂化轨道类型是______杂化。
(2)当n = 3时,A与B形成的晶体属于______晶体。
(3)若A元素的原子价电子排布为3s23p2,A、C、D三种元素的第一电离能由大到小的顺序是_______(用元素符号表示)。
(4)己知某红紫色配合物的组成为CoCl3 ·5NH3· H2O,该配合物中的中心离子钴离子在基态时的核外电子排布式为_______。
(5)金属铁的晶体在不同温度下有两种堆积方式,晶胞分别如图所示,体心立方晶胞和面心立方晶胞中实际含有的Fe原子个数之比为________。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有些科学家提出硅是“21世纪的能源”,下列有关硅及其化合物的说法正确的是
A. 硅在自然界中以游离态和化合态两种形式存在
B. 硅晶体是良好的半导体,可用于制造光导纤维
C. SiO2是酸性氧化物,不与任何酸发生反应
D. 木材浸过水玻璃后,不易着火
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应不属于可逆反应的是( )。
A. SO2溶于水和H2SO3分解 B. H2和I2化合生成HI和HI分解
C. SO2跟O2化合生成SO3和SO3分解 D. H2O电解生成H2和H2燃烧生成H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】砷的一些化合物常用作半导体、除草剂、杀鼠药等。回答下列问题:
(1)基态As原子的核外电子排布式为[Ar]__________,有 ______个未成对电子。
(2)镓氮砷合金材料的太阳能电池效率达40%。Ga、N、As电负性由大至小的顺序是 ___________。
(3)As4O6的分子结构如图所示,其中As原子的杂化方式为 _____mol。AS4O6含有![]() 键的物质的量为_________mol。
键的物质的量为_________mol。

(4)As与N是同主族兀素,AsH3的沸点(-62.5 ℃)比NH3的沸点(-33.5℃)低,原因是______。
(5)H3AsO4和H3AsO3是砷的两种含氧酸,根据结构与性质的关系,H3AsO4的酸性比
H3ASO3强的原因是_________。
(6)晶胞有两个基本要素:
①原子坐标参数,表示晶胞内部各原子的相对位置,LiZnAs基稀磁半导体的晶胞如图所示,其中原子坐标参数A处Li为(0,0,![]() );B处As为(
);B处As为(![]() ,
,![]() ,
,![]() );C处Li的坐标参数为__________。
);C处Li的坐标参数为__________。
②晶胞参数,描述晶胞的大小和形状,已知LiZnAs单晶的晶胞参数a = 594 pm,NA表示阿伏加德罗常数的数值,其密度为 ____g cm3 (列出计算式即可)

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲、乙两个研究性学习小组为测定氨分子张氮、氢原子个数比,设计了如下实验流程:

试验中,先用制得的氨气排尽洗气瓶前所有装置中的空气,再连接洗气瓶和气体收集装置,立即加热氧化铜。反应完成后,黑色的氧化铜转化为红色的铜。
下图A、B、C为甲、乙两小组制取氨气时可能用到的装置,D为盛,有浓硫酸的洗气瓶。
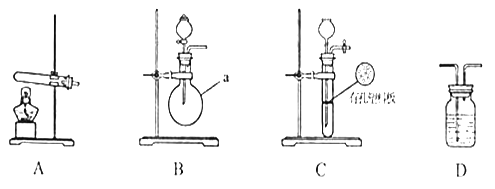
甲小组测得:反应前氧化铜的质量为m1 g、氧化铜反应后剩余固体的质量为m2 g生成氮气在标准状况下的体积V1 L。
乙小组测得:洗气前装置D的质量m3 g、洗气后装置后D的质量m4 g、生成氮气在标准状况下的体积V2 L。
请回答下列问题:
(1)写出仪器a的名称:__________________________________。
(2)检查A装置气密性的操作时___________________________________________。
(3)甲、乙两小组选择了不同方法制取氨气,请将实验装置的字母编号和制备原理填写在下表空格中。
实验装置 | 实验药品 | 制备原理 | |
甲小组 | A | 氢氧化钙、硫酸铵 | 反应的化学方程式为______________ |
乙小组 | _____ | 浓氨水、氢氧化钠 | 用化学平衡原理分析氢氧化钠的作用:_____________________________ |
(4)甲小组用所测数据计算出氨分子中氮、氢的原子个数之比为____________________。
(5)乙小组用所测数据计算出氨分子中氮、氢的原子个数比名校小于理论值,其原因是_______________________________ 。为此,乙小组在原有实验的基础上增加了一个装装有药品的实验仪器,重新实验.根据实验前后该药品的质量变化及生成氮气的体积,得出合理的实验结果.该药品的名称是____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列解释过程或事实的方程式不正确的是( )
A. 熔融烧碱时,不能使用普通石英坩埚:SiO2 + 2NaOH ![]() Na2SiO3 + H2O
Na2SiO3 + H2O
B. 在海带灰的浸出液(含有I-)中滴加H2O2得到I2:2I- + H2O2 + 2H+ == I2 + O2↑+ 2H2O
C. 红热的铁丝与水接触,表面形成蓝黑色(或黑色)保护层:3Fe + 4H2O ![]() Fe3O4 + 4H2
Fe3O4 + 4H2
D. “84消毒液” (有效成分NaClO)和“洁厕灵”(主要成分盐酸)混合使用放出氯气:ClO-+Cl-+2H+== Cl2↑+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】S2C12是广泛用于橡胶工业的硫化剂,常温下,S2C12是一种橙黄色的液体,遇水易水解,并产生 能使品红褪色的气体。S2Cl2的结构与H2O2类似。下列说法不正确的是( )

A. S2C12分子中的两个S原子均是sp3杂化
B. S2C12 与 H2O 反应的化学方程式是:2S2C12 +2H2O=SO2↑+3S↓+4HC1
C. S2Br2 与 S2C12 结构相似,熔、沸点:S2Br2 >S2C12
D. S2C12是含有极性键和非极性键的非极性分子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】标准状况下VL氨气溶解在1L水中(水的密度近似为1g/mL),所得溶液的密度为ρg/mL,质量分数为ω,物质的量浓度为cmol/L,则下列关系中不正确的是( )
A. ![]() B.
B. ![]() C.
C. ![]() D.
D. ![]()
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com