
【题目】(1)某简单离子的结构示意图可表示为

(1)当x=8时,该粒子符号为___________,当x=11时,该粒子符号为______________,当x=13时,写出该粒子的硝酸盐的的化学式为:_____________。
(2)在一定温度下,向15g 蒸溜水中加入无水硫酸铜粉末,充分搅拌并过滤,得到一定质量的蓝色五水合硫酸铜晶体和8.4g滤液,若此温度下无水硫酸铜的溶解度为40g,则加入的无水硫酸铜的质量是__________________。
(3)已知难溶的物质在一定条件在可转化成更难溶的物质.在含有氯化银沉淀的试管中加入碘化钾溶液,振荡后可观察到白色沉淀逐渐变为黄色沉淀。请写出反应的化学方程。____________________.
(4)x=11 的单质能与水反应产生一种可燃性气体,反应后的溶液能酚酞指示剂变红色,根据现象写出相关的化学方程式_________________.
【答案】(1)O2-;Na+;Al(NO3)3;
(2)18.4g;
(3)AgCl+KI=AgI+KCl;
(4)2Na+2H2O=2NaOH+H2↑
【解析】
试题分析:(1)某简单粒子的结构示意图可表示为![]() :当X=8时,质子数=8,核外电子数=10,质子数<核外电子数,为氧离子,粒子的符号为O2-;当X=11时,质子数=11>核外电子数=10,为钠离子,其离子符号为:Na+;当X=13时,质子数=13,核外电子数=10,质子数>核外电子数,为铝离子;与硝酸根化合形成的化合物为硝酸铝,铝元素显+3价,硝酸根显-1价,其化学式为:Al(NO3)3,故答为:O2-;Na+;Al(NO3)3;
:当X=8时,质子数=8,核外电子数=10,质子数<核外电子数,为氧离子,粒子的符号为O2-;当X=11时,质子数=11>核外电子数=10,为钠离子,其离子符号为:Na+;当X=13时,质子数=13,核外电子数=10,质子数>核外电子数,为铝离子;与硝酸根化合形成的化合物为硝酸铝,铝元素显+3价,硝酸根显-1价,其化学式为:Al(NO3)3,故答为:O2-;Na+;Al(NO3)3;
(2)向15g蒸馏水加入无水硫酸铜粉末,充分搅拌并过滤,得到一定质量的蓝色五水合硫酸铜晶体和8.4g滤液,此温度下无水硫酸铜的溶解度为40g,设滤液中含硫酸铜的质量为x,则![]() =
=![]() ,x=2.4g,则滤液中含水的质量为8.4g-2.4g=6g,故五水合硫酸铜晶体(CuSO45H2O)中含水的质量为15g-6g=9g,则含硫酸铜的质量为9g×=16g,此无水硫酸铜的质量是2.4g+16g=18.4g,故答案为:18.4g;
,x=2.4g,则滤液中含水的质量为8.4g-2.4g=6g,故五水合硫酸铜晶体(CuSO45H2O)中含水的质量为15g-6g=9g,则含硫酸铜的质量为9g×=16g,此无水硫酸铜的质量是2.4g+16g=18.4g,故答案为:18.4g;
(3)由难溶的物质在一定条件下可转化成更难溶的物质,在成有氯化银沉淀的试管中加入碘化钾溶液,振荡后可观察到白色沉淀逐渐变为黄色沉淀,是因为AgI比AgCl更难溶,其反应为AgCl+KI═AgI↓+KCl,故答案为:AgCl+KI═AgI↓+KCl;
(4)核电荷数为11的元素是钠,钠能与水反应产生一种可燃性气体,气体是氢气,反应后的溶液能酚酞指示剂变红色,生成了碱,为氢氧化钠,反应的化学方程式为2Na + 2H2O = 2NaOH + H2↑,故答案为:2Na + 2H2O = 2NaOH + H2↑。


科目:高中化学 来源: 题型:
【题目】已知甲、乙、丙、丁是中学化学常见的物质,一定条件下可发生如下转化:
![]() ,下列相关离子方程式或化学方程式错误的是
,下列相关离子方程式或化学方程式错误的是
A. ①可能为AlO2-+H++H2O=Al(OH)3↓
B. ①可能为Fe+2Fe3+=3Fe2+
C. ②可能为2NO+O2=2NO2
D. ②可能为Na2CO3+H2O+CO2=2NaHCO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应的离子方程式不正确的是( )
A.Cl2与稀NaOH溶液反应:Cl2+2OH﹣═Cl﹣+ClO﹣+H2O
B.Fe2(SO4)3和KI溶液反应:Fe3++2I﹣═Fe2++I2
C.烧碱溶液中加入铝片:2Al+2OH﹣+2H2O═2AlO2﹣+3H2↑
D.用浓盐酸与MnO2反应制取少量氯气:MnO2+4H++2Cl﹣![]() Mn2++Cl2↑+2H2O
Mn2++Cl2↑+2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某地环保部门取一定量某工厂所排废水试样分成甲、乙、丙、丁四份,进行如图所示探究.

已知废水试样中可能含有下表中的离子:
阳离子 | Na+、Mg2+、X |
阴离子 | Cl﹣、SO32﹣、Y、NO3﹣ |
(1)离子X是 (填化学式,下同),离子Y是 .
(2)表中不能确定是否存在的阴离子是 ,能证明该阴离子是否存在的简单实验操作为 .
(3)丁组实验在酸性条件下发生反应的离子方程式是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将钠、镁、铝各0.3 mol,分别放入100 mL 1 mol·L—1的硫酸中,同温同压下产生的气体的体积比是
A. 1∶2∶3 B. 6∶3∶2 C. 3∶2∶2 D. 3∶1∶1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质的转化在给定条件下能实现的是( )
A.H2SO4(稀)![]() SO2
SO2![]() NH4HSO3
NH4HSO3![]() (NH4)2SO3
(NH4)2SO3
B.NH3![]() NO
NO![]() NO2
NO2![]() HNO3
HNO3
C.Fe![]() FeCl2
FeCl2![]() Fe(OH)2
Fe(OH)2![]() Fe(OH)3
Fe(OH)3
D.Al![]() NaAlO2
NaAlO2![]() AlCl3溶液
AlCl3溶液![]() 无水AlCl3
无水AlCl3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了将混有K2SO4、MgSO4的KNO3固体提纯,并制得纯净的KNO3溶液,某学生设计如下实验方案:

(1)操作①为_____________________;
(2)操作②③④加入的试剂依次可以为:___________、____________、____________。
(3)如何判断SO42-已除尽,简述实验操作_________________________。
(4)实验过程中产生的多次沉淀__________(填“需要”或“不需要”)多次过滤,理由是_______________。
(5)该同学的实验设计方案___________(填“合理”或“不合理”),理由是___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫化亚铁煅烧得到的烧渣的主要成分为FeO、Fe3O4和Fe2O3等。利用该烧渣制备铁红和副产品无氯钾肥的流程如下:
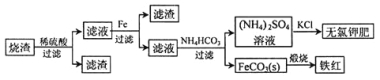
回答下列问题:
(1)煅烧硫化亚铁若生成Fe2O3和SO2,则生成标准状况下11.2L SO2气体,转移电子的物质的量为____________。
(2)该流程中加入铁粉的作用是____________(用离子方程式表示)。
(3)已知四种盐的溶解度随温度变化的曲线如图所示。请回答下列问题:
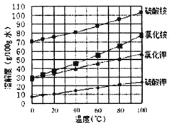
①向滤液II中加入NH4HCO3溶液所发生反应的离子方程式是________________。
②向(NH4)2SO4溶液加入KCl后得到无氯钾肥应进行的操作为_________、________、洗涤、干燥等;反应的化学方程式为_______________。
(4)用含少量硫酸亚铁和硫酸铁的硫酸铜溶液制备CuSO4·5H2O的流程如下:
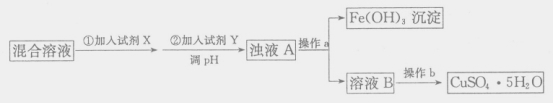
加入试剂X的目的是_____,调节溶液pH的试剂Y可能是_____(填字母编号)。
a.NaOH
b.CuO
c.NH3·H2O
d.Cu(OH)2CO3
Cu2+为0.2mol·L-1的溶液,欲除尽Fe3+(当离子浓度小于1*10-5mol·L-1时,离子已沉淀完全,)调整溶液pH的精确范围是_____(已知:Kap[Cu(OH)2]=2×10-20,Kap[Fe(OH)3]=8.0×10-38,lg2=0.3)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com