
【题目】有关物质的量的计算是中学化学的重要部分,请按要求填空:
(1)2molO2和__gCH4在标准状况下占有相同的体积,其体积为___L。
(2)标况下,现有96g的氧气和44.8升的二氧化碳两者的密度之比为___;两者的体积之比为___。
(3)将等物质的量的NH3和CH4混合,混合气体中NH3与CH4的质量比为___。
(4)要使NH3与CH4含相同数目的H原子,则NH3和CH4的物质的量之比为___。
(5)在某温度下,NaOH的溶解度为20g,该温度下将80gNaOH投入220g水中,充分搅拌后,测得溶液的密度为1.2g/mL,则该溶液中溶质的物质的量浓度为___。
【答案】32 44.8 8:11 3:2 17:16 4:3 5mol/L
【解析】
(1)根据V=nVm知,相同状况下,气体的体积比等于物质的量之比,则甲烷的物质的量为2mol,则甲烷的质量为m=nM=2mol×16g/mol=32g,其体积V=nVm=2mol×22.4L/mol=44.8L;
故答案为:32;44.8;
(2)气体的密度![]() ,同温同压下,气体物质有以下关系
,同温同压下,气体物质有以下关系![]() ,则氧气和二氧化碳的密度之比为32:44=8:11;氧气的物质的量为
,则氧气和二氧化碳的密度之比为32:44=8:11;氧气的物质的量为![]() ,二氧化碳物质的量为
,二氧化碳物质的量为![]() ,相同状况下,气体的体积比等于物质的量之比,则氧气与二氧化碳的体积比为3:2;
,相同状况下,气体的体积比等于物质的量之比,则氧气与二氧化碳的体积比为3:2;
故答案为:8:11;3:2;
(3)由m=nM知,等物质的量的NH3和CH4的质量比等于其摩尔质量之比,为17:16;
故答案为:17:16;
(4)设NH3和CH4的物质的量分别为x mol、y mol,由分子的构成及含相同数目的H原子可知,3x=4y,则x:y=4:3,则NH3和CH4的物质的量之比为4:3;
故答案为:4:3;
(5)已知在某温度下,NaOH的溶解度为20g,设220g水溶解x gNaOH,则有:![]() ,解得x=44g,说明溶液过饱和了,所以溶液的质量分数为
,解得x=44g,说明溶液过饱和了,所以溶液的质量分数为![]() ,则该溶液中溶质的物质的量浓度为
,则该溶液中溶质的物质的量浓度为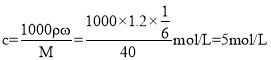 ;
;
故答案为:5mol/L。


 孟建平小学滚动测试系列答案
孟建平小学滚动测试系列答案科目:高中化学 来源: 题型:
【题目】常温下,用0.10molL1的NaOH溶液分别滴定20.00mL浓度均为0.10molL1的CH3COOH溶液和HCN溶液,所得滴定曲线如图所示,下列说法正确的是( )

A. 点①和点②所示溶液中:c(CH3COO)<c(CN)
B. 点④所示溶液中:c(Na+)>c(OH)>c(CH3COO)>c(H+)
C. 点①和点②所示溶液中:c(CH3COO)c(CN)=c(HCN)c(CH3COOH)
D. 点③所示溶液中:c(CH3COO)+c(OH)=c(CH3COOH)+c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酰氯(SO2Cl2)是重要的化学试剂,可由如下反应制取:SO2(g)+Cl2(g)![]() SO2Cl2(g)△H针对该反应回答下列问题:
SO2Cl2(g)△H针对该反应回答下列问题:
(1)已知:①SO2(g)+Cl2(g)+SCl2(g)![]() 2SOCl2(g)△H1=﹣akJmol﹣1
2SOCl2(g)△H1=﹣akJmol﹣1
②SO2Cl2+SCl2(g)=2SOCl2(g)△H2=﹣bkJmol﹣1
③a>b>0则△H=______kJmol﹣1(用含a、b的代数式表示)
(2)为了提高该反应中Cl2的平衡转化率,下列措施合理的是______(填字母序号).
a.缩小容器体积 b.使用催化剂 c.增加SO2浓度 d.升高温度
(3)若在绝热、恒容的密闭体系中,投入一定量SO2和Cl2,发生该反应,下列示意图能说明t1时刻反应达到平衡状态的是______(填字母序号).(下图中υ正、K、n、m分别表示正反应速率、平衡常数、物质的量和质量)

(4)若在催化剂作用下,将nmolSO2与nmolCl2充入容积可变的密闭容器中,并始终保持温度为T,压强为P.起始时气体总体积为10L,t min时反应达到平衡状态,此时气体总体积为8L.
①在容积改变的条件下,反应速率可用单位时间内反应物或生成物的物质的量变化来表示.则υ(SO2)=____.
②此温度下,该反应的K=___.
③相同条件下,若将0.5nmolSO2与0.5nmolCl2充入该容器,到达平衡状态时,混合物中SO2Cl2的物质的量是____.
(5)该反应的产物SO2Cl2遇水发生剧烈水解生成两种强酸,写出其化学方程式____;已知25℃时,Ksp[AgCl]=1.8×10﹣10,Ksp[Ag2SO4]=1.4×10﹣5,则SO2Cl2于水所得溶液中逐滴加入AgNO3稀溶液时,最先产生的沉淀是______.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】最近我国科学家设计了一种CO2+H2S协同转化装置,实现对天然气中CO2和H2S的高效去除。示意图如图所示,其中电极分别为ZnO@石墨烯(石墨烯包裹的ZnO)和石墨烯,石墨烯电极区发生反应为:

①EDTA-Fe2+-e-=EDTA-Fe3+
②2EDTA-Fe3++H2S=2H++S+2EDTA-Fe2+
该装置工作时,下列叙述错误的是
A. 阴极的电极反应:CO2+2H++2e-=CO+H2O
B. 协同转化总反应:CO2+H2S=CO+H2O+S
C. 石墨烯上的电势比ZnO@石墨烯上的低
D. 若采用Fe3+/Fe2+取代EDTA-Fe3+/EDTA-Fe2+,溶液需为酸性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知某“84消毒液”瓶体部分标签如图所示,该“84消毒液”通常稀释100倍(体积之比)后使用。请回答下列问题:

(1)该“84消毒液”的物质的量浓度约___mol·L-1(小数点后保留一位)。
(2)某同学取100mL该“84消毒液”,稀释后用于消毒,稀释后的溶液中c(Na+)=___mol·L-1。
(3)该同学参阅该“84消毒液”的配方,欲用NaClO固体配制480mL含NaClO质量分数为25%的消毒液。需要称量NaClO固体的质量为__g。下列为打乱了的操作示意图,其正确排序为____。

(4)配制过程中下列各项操作对消毒液物质的量浓度有和影响(填“偏小”、“偏大”或“无影响”)
A.用托盘天平称量NaClO固体时,砝码生锈___。
B.容量瓶用蒸馏水洗涤后未干燥,含有少量蒸馏水____。
C.定容时,俯视容量瓶刻度线进行定容____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在密闭容中发生下列反应aA(g)![]() cC(g)+dD(g),反应达到平衡后,将气体体积压缩到原来的一半,再次达到平衡时,D的浓度为原平衡的1.8倍,下列叙述正确的是( )
cC(g)+dD(g),反应达到平衡后,将气体体积压缩到原来的一半,再次达到平衡时,D的浓度为原平衡的1.8倍,下列叙述正确的是( )
A. A的转化率变大 B. 平衡向正反应方向移动
C. D的体积分数变大 D. a < c+d
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下向10 mL 0.1 mol·L-1 NaOH溶液中加入0.1 mol·L-1的一元
酸HA,溶液pH的变化曲线如图所示。下列说法正确的是

A. a点所示溶液中c(Na+)>c(A-)>c(H+)>c(HA)
B. a、b两点所示溶液中水的电离程度相同
C. pH=7时,c(Na+)=c(A-)+c(HA)
D. b点所示溶液中c(A-)>c(HA)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲、乙、丙、丁为中学常见物质,其中甲、乙为单质,丙为氧化物,它们之间存在如图所示的转化关系:

下列说法正确的是( )
A. 若甲、乙元素是同主族元素,根据元素周期表推测,此时乙单质可能是Si
B. 若甲、乙均为金属单质,则丁所属的物质类别一定是碱性氧化物
C. 若甲为金属单质,乙为非金属单质,则甲只能是Mg
D. 若甲、乙元素是同周期元素,则该反应的化学方程式一定为:2F2 + 2H2O=4HF + O2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】普洱茶具有独特的香气,是云南的旅游名片之一。橙花叔醇是影响其香气的物质之一,结构如图所示。下列说法正确的是
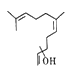
A. 该物质的化学式是C15H26O
B. 该物质不能使酸性高锰酸钾溶液褪色
C. 该物质的同分异构体可以是芳香族化合物
D. 该物质可以发生加成反应,不能发生消去反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com