
【题目】常温下,用0.10molL1的NaOH溶液分别滴定20.00mL浓度均为0.10molL1的CH3COOH溶液和HCN溶液,所得滴定曲线如图所示,下列说法正确的是( )

A. 点①和点②所示溶液中:c(CH3COO)<c(CN)
B. 点④所示溶液中:c(Na+)>c(OH)>c(CH3COO)>c(H+)
C. 点①和点②所示溶液中:c(CH3COO)c(CN)=c(HCN)c(CH3COOH)
D. 点③所示溶液中:c(CH3COO)+c(OH)=c(CH3COOH)+c(H+)
【答案】C
【解析】
根据图知,相同浓度的HCN和CH3COOH溶液中,pH:CH3COOH<HCN,说明CH3COOH酸性大于HCN,分别加入10mLNaOH溶液时,其溶质分别是NaCN和HCN、CH3COOH和CH3COONa且物质的量浓度相等。
A.点①溶液呈碱性,则c(OH)>c(H+),说明CN水解程度大于HCN电离程度,则c(CN)<c(Na+)<c(HCN),点②溶液呈酸性,则c(OH)<c(H+),说明CH3COO水解程度小于CH3COOH电离程度,所以c(CH3COO)>c(Na+)>c(CH3COOH),则c(CH3COO)>c(CN),A错误;
B.点④溶液为醋酸钠溶液,醋酸钠为强碱弱酸盐,少量的弱酸根离子水解,水溶液呈碱性,则c(OH)>c(H+),结合电荷守恒得c(Na+)>c(CH3COO),则c(Na+)>c(CH3COO)>c(OH)>c(H+),B错误;
C.已知均为0.10molL1的CH3COOH溶液和HCN溶液20.00mL,则醋酸的物质的量与氰酸相等,根据物料守恒得c(CH3COO)+c(CH3COOH)=c(CN)+c(HCN),则c(CH3COO)c(CN)=c(HCN)c(CH3COOH)等式成立,C正确;
D.点③溶液呈中性,则c(OH)=c(H+),结合电荷守恒得c(Na+)=c(CH3COO),则c(CH3COO)+c(OH)=c(Na+)+c(H+),根据点②,c(CH3COO)=c(CH3COOH)时,溶液显酸性,与点③所示不符,D错误;
答案为C。


科目:高中化学 来源: 题型:
【题目】已知:①Fe+H2SO4(稀)=FeSO4+H2↑
②Cu+2H2SO4(浓)![]() CuSO4+2H2O+SO2↑
CuSO4+2H2O+SO2↑
③KClO3+6HCl(浓)=KCl+3Cl2↑+3H2O。
试回答下列问题:
(1)当反应①转移3mol电子时,消耗H2SO4的质量是___g,产生氢气的体积(标准状况)_____L。
(2)反应②中_______作氧化剂,________是氧化产物。
(3)当反应②中生成11.2LSO2气体(标准状况下)时,被还原的H2SO4的物质的量是____。
(4)用双线桥法表示反应②电子转移的方向和数目(在化学方程式上标出)_______。
(5)反应③中氧化产物与还原产物的物质的量之比为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有FeO、Fe2O3的混合物若干克,在足量H2气流中加热充分反应,冷却后称得剩余固体比原混合物减轻0.8g;将等质量的原混合物与盐酸反应,欲使之完全溶解, 至少需要1molL﹣1的盐酸的体积为( )
A. 0.05 LB. 0.1 LC. 0.2 LD. 1 L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】标准状况下,等体积的NH3和CH4两种气体,下列有关说法错误的是
A.所含分子数目相同B.所含氢原子物质的量之比为3∶4
C.质量之比为16∶17D.密度之比为17∶16
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验操作、现象和结论均正确的是( )
选项 | 实验操作 | 现象 | 结论 |
A | 植物油和溴水混合后振荡、静置 | 溶液分层,溴水褪色 | 植物油萃取了溴水中的Br2 |
B | 将硫酸酸化的H2O2滴入Fe(NO3)2溶液中 | 溶液变黄色 | H2O2的氧化性比Fe3+弱 |
C |
| 出现白色沉淀 | 氨气、二氧化碳与饱和食盐水反映生成碳酸钠 |
D | 将盛有铜与浓硫酸的试管加热,发现试管底部出现白色固体,倒去试管中液体,再加入适量水 | 白色固体溶解,溶液显蓝色 | 白色固体为无水硫酸铜 |
A. AB. BC. CD. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】三氧化二锰(Mn2O3)在现代工业上应用广泛。以软锰矿(主要成分为MnO2)和硫锰矿(主要成分为MnS)为原料制备高纯度硫酸锰进而制备三氧化二锰的工艺流程如下(两种矿物中均不存在单质杂质):
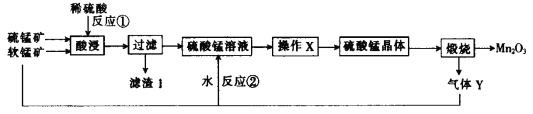
(1)MnS、Mn2O3、MnO2中锰元素的化合价均不同,已知锰有多种化合价,请再写出两种含锰且锰的化合价不同的化合物的化学式:______________。
(2)滤渣1中存在一种非金属单质,则“酸浸”时反应①的化学方程式为________________。
(3)操作X为蒸发浓缩、________、________、洗涤烘干。经操作X之后得到MnSO4H2O。在洗涤操作中,常用酒精洗涤MnSO4H2O晶体,主要目的是_______________________。
(4)气体Y直接排放会污染空气,将Y的水溶液与软锰矿反应可得硫酸锰,反应②的化学方程式为______。
(5)Mn2O3与MnO2类似,也能与浓盐酸反应,其反应的离子方程式为____________。
(6)用标准的BaCl2溶液测定样品中MnSO4H2O的质量分数时,发现样品纯度大于100%(测定过程中产生的误差可忽略),其原因可能是_________________(任写一点)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】恒温恒容下,将2molA气体和2molB气体通入体积为2L的密闭容器中发生如下反应:2A(g)+B(g)![]() xC(g)+2D(s),2min时反应达到平衡状态,此时剩余1.2molB,并测得C的浓度为1.2mo1·L—1。
xC(g)+2D(s),2min时反应达到平衡状态,此时剩余1.2molB,并测得C的浓度为1.2mo1·L—1。
(1)从开始反应至达到平衡状态,生成C的平均反应速率为____________________。
(2)x =________。
(3)A的转化率与B的转化率之比为___________。
(4)下列各项可作为该反应达到平衡状态的标志的是_________。
A.压强不再变化
B.气体密度不再变化
C.气体平均相对分子质量不再变化
D.A的消耗速率与B的消耗速率之比为2∶1
(5)欲使反应达到平衡时,C的物质的量分数与上述平衡相等,起始加入A、B的物质的量n(A)和n(B)之间应满足的关系为 ________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用高效的二氧化氯(ClO2)替代液氯进行消毒,可避免产生对人体健康有害的有机氯代物。
(1)工业上,ClO2常用NaClO3和Na2SO3溶液混合并加硫酸酸化后反应制得,则化学反应方程式为___,在该反应中NaClO3和Na2SO3的物质的量之比为________。
(2)有效氯含量是含氯消毒剂的一个重要指标,有效氯含量的定义:从HI中氧化出相同量的I2所需Cl2的质量与指定含氯消毒剂的质量之比,常用百分数表示。则ClO2的有效氯含量是________。
(3)化学小组的同学欲对用ClO2消毒过的自来水进行氯元素含量的测定(假定ClO2全部转化为Cl-),他们进行了如下实验:向30.00 mL水样中加几滴K2CrO4溶液作指示剂,用0.001 mol·L-1AgNO3溶液滴定,当有砖红色Ag2CrO4沉淀出现时,达滴定终点,此时用去AgNO3溶液12.12 mL。
①水样中Cl-的物质的量浓度是________。
②已知Ksp(AgCl)=1.780×10-10,Ksp(Ag2CrO4)=2.00×10-12。如在滴定终点时,测得溶液中CrO42-的浓度是5.000×10-3mol·L-1。试计算此时溶液中Cl-的浓度是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有关物质的量的计算是中学化学的重要部分,请按要求填空:
(1)2molO2和__gCH4在标准状况下占有相同的体积,其体积为___L。
(2)标况下,现有96g的氧气和44.8升的二氧化碳两者的密度之比为___;两者的体积之比为___。
(3)将等物质的量的NH3和CH4混合,混合气体中NH3与CH4的质量比为___。
(4)要使NH3与CH4含相同数目的H原子,则NH3和CH4的物质的量之比为___。
(5)在某温度下,NaOH的溶解度为20g,该温度下将80gNaOH投入220g水中,充分搅拌后,测得溶液的密度为1.2g/mL,则该溶液中溶质的物质的量浓度为___。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com