
����Ŀ�����º����£���2molA�����2molB����ͨ�����Ϊ2L���ܱ������з������·�Ӧ��2A(g)+B(g)![]() xC(g)+2D(s)��2minʱ��Ӧ�ﵽƽ��״̬����ʱʣ��1.2molB�������C��Ũ��Ϊ1.2mo1��L��1��
xC(g)+2D(s)��2minʱ��Ӧ�ﵽƽ��״̬����ʱʣ��1.2molB�������C��Ũ��Ϊ1.2mo1��L��1��
(1)�ӿ�ʼ��Ӧ���ﵽƽ��״̬������C��ƽ����Ӧ����Ϊ____________________��
(2)x =________��
(3)A��ת������B��ת����֮��Ϊ___________��
(4)���и������Ϊ�÷�Ӧ�ﵽƽ��״̬�ı�־����_________��
A��ѹǿ���ٱ仯
B�������ܶȲ��ٱ仯
C������ƽ����Է����������ٱ仯
D��A������������B����������֮��Ϊ2��1
(5)��ʹ��Ӧ�ﵽƽ��ʱ��C�����ʵ�������������ƽ����ȣ���ʼ����A��B�����ʵ���n(A)��n(B)֮��Ӧ����Ĺ�ϵΪ ________________________��
���𰸡� 0.6mo1��L��1��min��1 3 2:1 BC n(A) = n(B)��n(A):n(B)=1:1
����������1��2min�ﵽƽ�⣬C��Ũ��Ϊ1.2mol/L���������C��ƽ����Ӧ����Ϊ1.2mol/L��2min=0.6mol/��L��min����
��2�� 2A(g)+B(g)![]() xC(g)+2D(s)
xC(g)+2D(s)
��ʼ����mol�� 2 2 0
ת������mol�� 1.6 0.8 0.8x
ƽ������mol�� 0.4 1.2 0.8x
��0.8xmol��2L��1.2mol/L�����x��3
��3��A��B��ת����֮��Ϊ![]() ��
��
��4��A���÷�Ӧ��ѹǿʼ�ղ��䣬�����ж�ƽ�⣬A����B��������������ڱ仯���������ܶȲ��ٱ仯���ﵽƽ�⣬B��ȷ��C��������������ڱ仯������������ʵ������䣬������ƽ����Է����������ٱ仯���ﵽƽ�⣬C��ȷ��D��A������������B����������֮��Ϊ2��1����ϵʼ�մ��ڣ������ж�ƽ�⣬D����ѡBC��
��5����ʹ��Ӧ�ﵽƽ��ʱC�����ʵ�������������ƽ����ȣ���ԭƽ��Ϊ��Чƽ�⣬����x=3����Ӧǰ������Ļ�ѧ���������䣬����ʼ�����A��B���ʵ���n��A����n��B��Ӧ��ԭƽ�����Ϊ1��1����n��A��=n��B����


 ��У����ϵ�д�
��У����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��˫��ˮ��һ����Ҫ����ɫ�Լ�����ҵ�Ͽɲ�ȡ����ϡŨ�ȵ���������ȡ˫��ˮ(H2O2Ϊ��ԭ����)������Ļ�ѧ����ʽΪ��3H2O+3O2![]() O3+3H2O2�������й�˵����ȷ����
O3+3H2O2�������й�˵����ȷ����
A. ���ص���������˫��ˮ���������ɳ���
B. ������H+��������
C. ���������ĵ缫��ӦʽΪ3H2O+6e-=O3+6H+
D. ����˫��ˮ�ĵ缫��ӦʽΪ2H2O-2e- =H2O2+2H+
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����1��ָ������ͼʵ��װ���еĴ���֮����(����װ�����ձ��ײ��ѵ���ʯ����)

��_____________________________________����_______________________________________��
��2����ͼ��ijѧ���Ĺ��˲���ʾ��ͼ����������淶����______�����ţ���

a���������������� b���ò�������©������������Լӿ�����ٶ�
c������ֽʪ��ʹ�����©���� d����ֽ��Ե�߳�©��
��.��������ȡ���������ͼ����֪���з�����Ӧ�Ļ�ѧ����ʽΪ��Cl2+2KI=2KCl+I2����ش��������⣺

��1��ָ����ȡ��Ĺ������й�ʵ������ٺ͢۵����ƣ�__________��________��
��2����3 mL��ˮ�У�����1mL���Ȼ�̼�������ú۲쵽�Թ���ķֲ���������ͼ�е�________(ע���Թ�����ɫ��Ϊ��ɫ��Һ)���²�_____ɫ��

��ij��Һ�к���MgSO4��Na2SO4�������ʣ�ѡ���ʵ��Լ�����Һ�е�þ����ת��Ϊ��������������������ʵ���������£�

��1����֤����Һ�д���SO42����OH -��ѡ�õķ�������ȡ��������Һ�μ�________��������Һ��죬�������м���________��Һ�����ְ�ɫ���������֤��SO42����OH - �����ڡ�
��2�����ϴ��Mg(OH)2������___________________________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ᾧõ��߷�����֬M�ĺϳ�·����ͼ��ʾ��
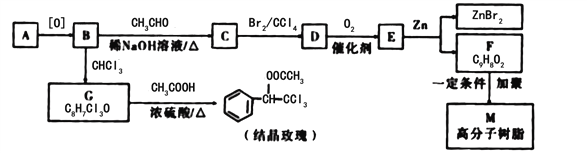
��֪:��A�DZ���ͬϵ��,����ͬ������,������������������ܶ�Ϊ46
��![]()
��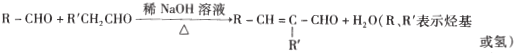
��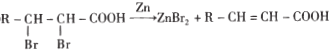
��1��C�к��������ŵ�����Ϊ______��E�Ľṹ��ʽΪ_____��
��2��д����G���ɽᾧõ��Ļ�ѧ����ʽ________________________________��
��3�������������С�C��D����M�ĺϳɹ����е�������___________________________
��4����֪G��һ��������ˮ������![]() ,д��H��������������ͬ���칹��Ľṹ��ʽ______________________________
,д��H��������������ͬ���칹��Ľṹ��ʽ______________________________
a���Ȼ�����Һ������ɫ��Ӧ
b�����ϵ�һ��ȡ����ֻ��һ��
c������������������Һ��Ӧ,![]() ������
������![]() NaOH
NaOH
��5��E��ͬ���칹��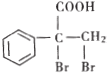 ��һ����Ҫ��ҩ���м���,��ϳ�·����E����,����
��һ����Ҫ��ҩ���м���,��ϳ�·����E����,����![]() Ϊԭ��������ĺϳ�·��(��������ԭ����ѡ)_______________.
Ϊԭ��������ĺϳ�·��(��������ԭ����ѡ)_______________.
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼ��һ���绯ѧ���̵�ʾ��ͼ���ش��������⣺

(1)�׳���___________(�ԭ��ء��������ء���Ƴء�)װ�ã���װ���е缫A��������_______(�����������������������������������)��
(2)��װ����ͨ��CH4�ĵ缫��ӦʽΪ__________________________________����װ���е缫B(Ag)�ĵ缫��ӦʽΪ________________________________����װ����D���IJ�����____________(д��ѧʽ)��
(3)һ��ʱ�䣬�������в���112 mL(��״��)����ʱ�����Ƚ�����أ�������Һ��25 ��ʱ��pH��________(��֪��NaCl��Һ������������Һ���Ϊ500 mL)����Ҫʹ���ػָ����ǰ��״̬��Ӧ�������ͨ��________(д��ѧʽ)��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪����A��B��C��D��E��F��һ�������µĹ�ϵ����ͼ��ʾ�����������ʵ���ɫ��Ӧ���ʻ�ɫ��
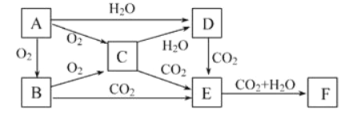
��1��д���������ʵ����ƣ�B____________��E_____��
��2��д��E��F�����ӷ���ʽ________________________��
F�����壩��E�Ļ�ѧ����ʽ_____________��
��3��д��C�������̼��Ӧ�Ļ�ѧ����ʽΪ��_____________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij��ҩ��ϳ��м���Ľṹ��ʽΪ �������йظ����ʵ�˵������ȷ������ ��
�������йظ����ʵ�˵������ȷ������ ��
A. ���ڷ����廯����
B. �ܷ�����ȥ��Ӧ����ԭ��Ӧ��������Ӧ�����ܷ���ˮ�ⷴӦ
C. 1 mol���л���������Na2CO3��Һ��Ӧ������2.5 mol Na2CO3
D. �ֱܷ������Na��NaOH��Һ��NaHCO3��Һ��Ӧ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����һ��������þ���Ͻ�Ͷ��400 mLϡ�����У�����ȫ���ܽⲢ�������塣����Ӧ��ȫ����������Һ�м���NaOH��Һ�����ɳ��������ʵ��������NaOH��Һ�������ϵ��ͼ��ʾ��
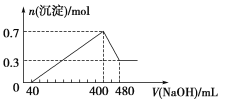
���㣺
��1���Ͻ���Mg������Ϊ________g��
��2����������ʵ���Ũ��Ϊ________ mol��L1��
��3��NaOH��Һ�����ʵ���Ũ��Ϊ________ mol��L1��
��4������H2�ڱ�״���µ����Ϊ________L��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com