
| A. | Al4C3晶体,熔点2200℃,熔融态不导电 | |
| B. | C3N4晶体具有比金刚石还大的硬度 | |
| C. | VF5晶体易溶于一些有机溶剂中 | |
| D. | BaCl2熔融状态下能够导电 |
 芝麻开花课程新体验系列答案
芝麻开花课程新体验系列答案科目:高中化学 来源: 题型:选择题
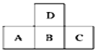
| A. | 只有A的单质存在同素异形体 | |
| B. | D的最高正价与B的最高正价相等 | |
| C. | A、B、C的最高价氧化物对应水化物的酸性强弱的关系是C>B>A | |
| D. | 原子半径的大小顺序是C>B>A>D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①② | B. | ④⑥ | C. | ③⑤ | D. | ②④ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
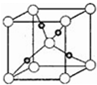 ④在一定条件下NH3和CO2能合成尿素CO(NH2)2,尿素中C原子轨道的杂化类型为;1mol尿素分子中,σ 键的数目为7NA.
④在一定条件下NH3和CO2能合成尿素CO(NH2)2,尿素中C原子轨道的杂化类型为;1mol尿素分子中,σ 键的数目为7NA.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 新制的氯水在光照下颜色变浅 | |
| B. | NO2和N2O4平衡混合气缩小体积加压后颜色变深 | |
| C. | 硫酸工业上SO2氧化成SO3,宜采用空气过量 | |
| D. | 煅烧硫铁矿利于SO2的生成 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 肼(N2H4)又称联氨,是一种可燃性的液体,可用作火箭燃料.
肼(N2H4)又称联氨,是一种可燃性的液体,可用作火箭燃料.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 分子中含有羟基的物质溶于水后,溶液一定显酸性 | |
| B. | 丙酸、乙酸甲酯、甲酸乙酯互为同分异构体 | |
| C. | 能发生银镜反应的一定是醛 | |
| D. | 乙醇发生酯化反应断裂碳氧键而失去羟基 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com