
【题目】下列反应过程中不存在电子转移的是( )
A.Zn+2HCl=ZnCl2+H2↑
B.Ca(ClO)2+2HCl=CaCl2+2HClO
C.Pb3O4+8HCl(浓)=3PbCl2+Cl2↑+4H2O
D.3Cl2+6KOH(浓)![]() 5KCl+KClO3+3H2O
5KCl+KClO3+3H2O
【答案】B
【解析】
因为发生电子转移的反应一定是氧化还原反应,所以此题实际是判断反应是否是氧化还原反应。
A.Zn+2HCl=ZnCl2+H2↑中Zn元素的化合价升高,H元素的化合价降低,则属于氧化还原反应,选项A不选;
B.Ca(ClO)2+2HCl=CaCl2+2HClO中没有元素的化合价变化,则不属于氧化还原反应,选项B选;
C.Pb3O4+8HCl(浓)=3PbCl2+Cl2↑+4H2O中Pb元素的化合价降低,Cl元素的化合价升高,则属于氧化还原反应,选项C不选;
D. 3Cl2+6KOH(浓)![]() 5KCl+KClO3+3H2O中Cl元素的化合价既升高又降低,则属于氧化还原反应,选项D不选;
5KCl+KClO3+3H2O中Cl元素的化合价既升高又降低,则属于氧化还原反应,选项D不选;
答案选B。


科目:高中化学 来源: 题型:
【题目】下表列出了9种元素在元素周期表中的位置示意。
周期 | ⅠA 1 | 0 18 | ||||||
1 | ⅡA 2 | ⅢA 13 | ⅣA 14 | ⅤA 15 | ⅥA 16 | ⅦA 17 | ||
2 | ① | ② | ③ | ④ | ⑤ | |||
3 | ⑥ | ⑦ | ⑧ | |||||
4 | ⑨ | |||||||
请回答下列问题:
(1)考古工作者利用元素②的一种核素测定一些文物的年代,这种核素的符号是_____
(2)画出元素⑧形成的简单离子的结构示意图_________________
(3)写出元素④和⑥的单质在加热条件下反应,所得产物的电子式为_________
(4)⑥元素的最高价氧化物对应的水化物含有的化学键是__________________
(5)②、③、④、⑤四种元素的简单气态氢化物中,稳定性最强的是_______(填化学式),写出元素⑥的单质与水反应的离子反应方程式___________________,写出一个能证明元素⑧比元素⑨非金属性强的反应事实的离子方程式__________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,装置在常温下工作(溶液体积变化忽略不计)。闭合K,灯泡发光。下列叙述中不正确的是( )
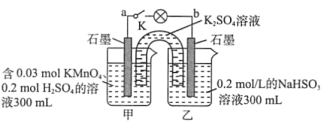
A.电池工作时,甲烧杯发生的反应为MnO4-被还原生成MnO2
B.电池工作时,盐桥中的K+移向甲烧杯,外电路的电子方向是从b到a
C.乙中电极反应为HSO3--2e-+H2O=SO42-+3H+
D.当电路中有1.204×1022个电子转移时,乙烧杯中溶液的H+浓度约为0.1mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知X、Y、Z、W四种元素是元素周期表中连续三个不同短周期的元素,且原子序数依次增大。X、W同主族,Y、Z为同周期的相邻元素。W原子的质子数等于Y、Z原子最外层电子数之和。Y的氢化物分子中有3个共价键。Z原子最外层电子数是次外层电子数的3倍。试推断:
(1)X、Y、Z、W四种元素的符号: X________、Y__________、Z____________、W、________
(2)由以上元素中的两种元素组成的能溶于水且水溶液显碱性的化合物的电子式分别为__________________,______________________。
(3)由X、Y、Z所形成的离子化合物是________________,它与W的最高氧化物的水化物的浓溶液加热时反应的离子方程式是________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,将NO(g)和O2(g)按物质的量之比2∶1充入反应容器,发生反应:2NO(g) + O2(g) ![]() 2NO2(g)。其他条件相同时,分别测得NO的平衡转化率在不同压强(p1、p2)下随温度变化的曲线如下图所示。下列说法正确的是
2NO2(g)。其他条件相同时,分别测得NO的平衡转化率在不同压强(p1、p2)下随温度变化的曲线如下图所示。下列说法正确的是

A. p1 < p2
B. 其他条件不变,温度升高,该反应的反应限度增大
C. 400℃、p1条件下,O2的平衡转化率为20%
D. 400℃时,该反应的化学平衡常数的数值为10/9
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关图像,其中说法正确的是

A. 由图Ⅰ知,反应在 T1、T3 处达到平衡
B. 由图Ⅰ知,该反应的△H<0
C. 由图Ⅱ知,t3时采取降低反应温度的措施
D. 由图Ⅱ知,反应在 t6时,NH3 体积分数最大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】不能正确表示下列变化的离子方程式是
A.BaCO3溶于盐酸:BaCO3+2H+=Ba2++CO2↑+H2O
B.FeCl3溶液腐蚀铜板:2Fe3++Cu=2Fe2++Cu2+
C.苯酚钠溶液中通入少量CO2:2![]() +CO2+H2O=2
+CO2+H2O=2![]() +CO32—
+CO32—
D.醋酸钠水解:CH3COO+H2O![]() CH3COOH+OH
CH3COOH+OH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)请用化学方程式写出如何检验牙膏中存在甘油的方法___。
(2)Ca3N2是离子化合物,各原子均满足8电子稳定结构。写出Ca3N2的电子式___。
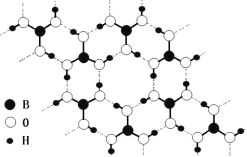
(3)常温常压下硼酸(H3BO3)晶体结构为层状,其二维平面结构如图。1mol硼酸(H3BO3)晶体中含有___mol氢键。从氢键的角度解释硼酸在冷水中的溶解度小而加热时溶解度增大:___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】晶体硅是一种重要的非金属材料,制备纯硅的主要步骤如下:
①高温下用碳还原二氧化硅制得粗硅。
②粗硅与干燥 HCl气体反应制得 SiHCl3:Si + 3HCl![]() SiHCl3+ H2
SiHCl3+ H2
③SiHCl3与过量 H2在 1000 ~1100℃反应制得纯硅
已知 ①SiHCl3能与 H2O强烈反应,在空气中易自燃②普通玻璃在6000C左右融化。
请回答下列问题:
(1)第①步制备粗硅的化学反应方程式为 __________________。
(2)粗硅与HCl反应完全后,经冷凝得到的SiHCl3(沸点 33.0℃)中含有少量 SiCl4(沸点57.6℃)
和 HCl(沸点-84.7℃),提纯 SiHCl3采用的方法为_________________________。
(3)用 SiHCl3与过量 H2反应制备纯硅的装置如下(热源及夹持装置略去):
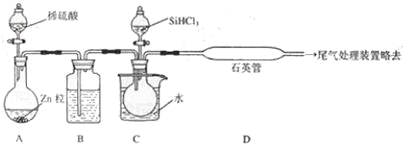
①装置 B中的试剂是 ___________。 装置 C中的烧瓶需要加热,其目的是__________________。
②反应一段时间后,装置 D中观察到的现象是 _________________,装置 D不能采用普通玻璃管的原因是__________________ ,装置D中发生反应的化学方程式为_______________。
③为保证制备纯硅实验的成功,操作的关键是检查实验装置的气密性,控制好反应温度以及____________________。
④为鉴定产品硅中是否含微量铁单质,将试样用稀盐酸溶解,取上层清液后需再加入的试剂(填写字母代号)是____________。
A 碘水 B 氯水 C NaOH溶液 D KSCN溶液 E Na2SO3 溶液
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com