
【题目】下表列出了9种元素在元素周期表中的位置示意。
周期 | ⅠA 1 | 0 18 | ||||||
1 | ⅡA 2 | ⅢA 13 | ⅣA 14 | ⅤA 15 | ⅥA 16 | ⅦA 17 | ||
2 | ① | ② | ③ | ④ | ⑤ | |||
3 | ⑥ | ⑦ | ⑧ | |||||
4 | ⑨ | |||||||
请回答下列问题:
(1)考古工作者利用元素②的一种核素测定一些文物的年代,这种核素的符号是_____
(2)画出元素⑧形成的简单离子的结构示意图_________________
(3)写出元素④和⑥的单质在加热条件下反应,所得产物的电子式为_________
(4)⑥元素的最高价氧化物对应的水化物含有的化学键是__________________
(5)②、③、④、⑤四种元素的简单气态氢化物中,稳定性最强的是_______(填化学式),写出元素⑥的单质与水反应的离子反应方程式___________________,写出一个能证明元素⑧比元素⑨非金属性强的反应事实的离子方程式__________
【答案】![]() 或
或![]()
![]()
![]() 离子键和极性键 HF 2Na+2H2O=2Na++2OH-+H2↑ Cl2+2Br=Br2+2Cl-
离子键和极性键 HF 2Na+2H2O=2Na++2OH-+H2↑ Cl2+2Br=Br2+2Cl-
【解析】
根据周期表提供的信息可知,①为Li ②C ③N④S⑤F ⑥Na ⑦Si⑧Cl ⑨Br;根据以上各元素及其形成的化合物的性质进行分析。
(1)考古时利用![]() 测定一些文物的年代;
测定一些文物的年代;
故答案为:![]() 或
或![]() ;
;
(2)元素⑧为17号元素,其形成的简单离子为Cl-,其结构示意图为:![]() ;
;
故答案为:![]()
(3)元素④为O,元素⑥为Na,其对应单质在加热条件下反应生成Na2O2,其电子式为:![]() ;
;
故答案为:![]()
(4)Na元素最高价氧化物对应的水化物为NaOH,所含微粒为Na+、OH-,因此NaOH中含有的化学键是离子键和极性键;
故答案为:离子键和极性键;
(5)②、③、④、⑤为同周期元素,从左到右,其元素非金属性逐渐增加,简单气态氢化物的稳定性逐渐增加,故稳定性最强的是HF;元素⑥为Na,其与水反应生成氢氧化钠、氢气,其离子反应方程式为:2Na+2H2O=2Na++2OH-+H2↑;元素⑧为Cl,元素⑨为Br,可通过置换反应证明单质氧化性强弱,从而证明元素非金属性强弱,其反应的离子方程式为:Cl2+2Br=Br2+2Cl-;
故答案为:HF;2Na+2H2O=2Na++2OH-+H2↑;Cl2+2Br=Br2+2Cl-。


科目:高中化学 来源: 题型:
【题目】为了探究木炭与浓H2SO4反应的产物中是否存在CO2,某同学选用如图所示装置进行实验:
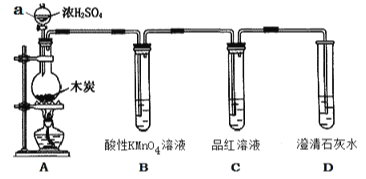
(1)仪器a的名称为:__________;在组装好上述实验装置后,在装入药品之前必需的实验操作是________________。
(2)写出A中发生反应的化学方程式____________________。该装置还可以用于实验室制取Cl2,请写出实验室制取Cl2的离子方程式并用单线桥标明电子转移________________。
(3)装置B的作用是____________________。
(4)能说明产物中一定存在CO2气体的实验现象为________________。
(5)质量分数为98%的浓硫酸,其密度为1.84g/ml,该浓硫酸的物质的量浓度为__________,用该硫酸配制500ml 0.5mol/L的稀硫酸,主要仪器除量筒、烧杯、玻璃棒、胶头滴管外,还需要____________,定容时由于俯视刻度线,则对浓度产生的影响为___________ (填“偏大”“偏小”或“无影响”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据下面的反应路线及所给信息填空。
(1)A的名称是________.
(2)③的反应类型是________,④的反应类型是________.
(3)反应②的化学方程式是________
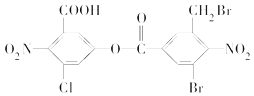
(4)某有机物的结构简式如图所示.1mol该有机物与足量的NaOH溶液共热,充分反应后质的量为________ mol.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关铁及其化合物说法不正确的是
A.将饱和氯化铁溶液滴入沸水中继续煮沸,可制得氢氧化铁胶体
B.FeCl2既有氧化性又有还原性
C.铁与硫酸铜溶液反应后滴加KSCN溶液,溶液变红
D.铁在氧气中点燃生成Fe3O4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关实验现象和解释或结论都正确的是( )
选项 | 实验操作 | 现象 | 解释或结论 |
A | 取硫酸催化淀粉水解的反应液,滴入少量新制 | 有砖红色沉淀生成 | 葡萄糖具有还原性 |
B |
| 有白色絮状沉淀生成 | 二者水解相互促进生成氢氧化铝沉淀 |
C | 将充满 | 红棕色变深 | 反应 |
D | 向 | 得到红褐色透明液体 | 得到 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氧化亚铜(Cu2O)是一种用途广泛的光电材料,某工厂以硫化铜矿石(含 CuFeS2、Cu2S等)为原料制取Cu2O的工艺流程如下:
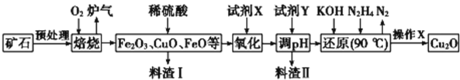
常温下几种物质开始形成沉淀与完全沉淀时的pH如下表:
Fe(OH)2 | Fe(OH)3 | Cu(OH)2 | |
开始沉淀 | 7.5 | 2.7 | 4.8 |
完全沉淀 | 9.0 | 3.7 | 6.4 |
(1)炉气中的有害气体成分是________,Cu2S与O2反应时,氧化剂与还原剂的物质的量之比为______。
(2)试剂X是H2O2溶液,当试剂X是___________时,更有利于降低生产成本。
(3)加入试剂Y调pH时,pH的调控范围是________。
(4)“还原”步骤中为提高N2H4转化率可采取的措施有_________(填序号)。
a.不断搅拌,使N2H4和溶液充分接触 b.增大通入N2H4的流速
c.减少KOH的进入量 d.减小通入N2H4的流速
(5)写出用N2H4制备Cu2O的化学方程式为_______________
(6)操作X包括烘干,其中烘干时要隔绝空气,其目的是____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学用50mL 0.50mol/L的盐酸与50mL 0.55mol/L的NaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程中所放出的热量计算中和热.
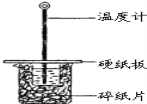
(1)下列说法不正确的是( )
A.该实验也可在保温杯中进行
B.图中实验装置缺少环形玻璃搅拌棒
C.烧杯间填满碎纸条的作用是保温、隔热,减少热量损失
D.若将盐酸体积改为60mL,两次实验所求得中和热不相等
(2)若通过实验测定中和热的△H的绝对值常常小于57.3kJ/mol,其原因可能是_________
A.实验装置保温、隔热效果差
B.分多次把NaOH溶液倒入盛有盐酸的小烧杯中
C.量取NaOH溶液的体积时仰视读数
D.用温度计测定盐酸初始温度后,直接测定氢氧化钠溶液的温度
(3)将一定量的稀氨水、稀氢氧化钠溶液、稀氢氧化钡溶液分别和1 L 1 mol·L-1的稀盐酸恰好完全反应,其反应热分别为ΔH1、ΔH2、ΔH3,则ΔH1、ΔH2、ΔH3的大小关系为__________;
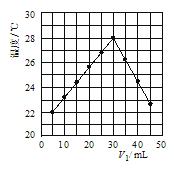
(4)若将V1mL1.0molL-1 HCl溶液和V2mL未知浓度的NaOH溶液混合均匀后测量并记录溶液温度,实验结果如图所示(实验中始终保持V1+V2=50mL).由图2可知,氢氧化钠的浓度为 __________ ;
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铜与锌用导线连接后,插入稀硫酸中形成原电池。
(1)分析图并填空:__。
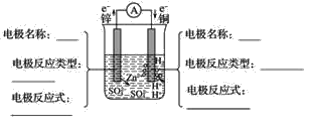
(2)原电池总反应式(离子方程式)__。
(3)上述装置产生电流的原因是__。
(4)上述装置的能量转化是__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应过程中不存在电子转移的是( )
A.Zn+2HCl=ZnCl2+H2↑
B.Ca(ClO)2+2HCl=CaCl2+2HClO
C.Pb3O4+8HCl(浓)=3PbCl2+Cl2↑+4H2O
D.3Cl2+6KOH(浓)![]() 5KCl+KClO3+3H2O
5KCl+KClO3+3H2O
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com