
【题目】下列有关实验现象和解释或结论都正确的是( )
选项 | 实验操作 | 现象 | 解释或结论 |
A | 取硫酸催化淀粉水解的反应液,滴入少量新制 | 有砖红色沉淀生成 | 葡萄糖具有还原性 |
B |
| 有白色絮状沉淀生成 | 二者水解相互促进生成氢氧化铝沉淀 |
C | 将充满 | 红棕色变深 | 反应 |
D | 向 | 得到红褐色透明液体 | 得到 |
A.AB.BC.CD.D
【答案】C
【解析】
A.向淀粉的酸性水解液中先加入氢氧化钠溶液中和,然后再滴入少量新制Cu (OH)2悬浊液并加热,出现砖红色沉淀,可以检验水解产物葡萄糖,否则酸与氢氧化铜反应,影响了实验结果,故A错误;
B.NaAlO2溶液与NaHCO3溶液混合,反应生成氢氧化铝沉淀和碳酸钠,是强酸制取弱酸,不是双水解原理,故B错误;
C.充满NO2的密闭玻璃球浸泡在热水中,颜色加深,说明升高温度平衡向生成二氧化氮的方向移动,则2NO2N2O4的△H<0,故C正确;
D.FeCl3饱和溶液中逐滴滴入足量浓氨水,发生反应生成沉淀,不能得到胶体,应将FeCl3饱和溶液加入沸水中发生水解制备氢氧化铁胶体,故D错误;
答案选C。


科目:高中化学 来源: 题型:
【题目】丁烯是一种重要的化工原料,可由丁烷催化脱氢制备。回答下列问题:
(1)正丁烷(C4H10)脱氢制1-丁烯(C4H8)的热化学方程式如下:
①C4H10(g)= C4H8(g)+H2(g) ΔH1
已知:②C4H10(g)+ ![]() O2(g)= C4H8(g)+H2O(g) ΔH2=-119 kJ·mol-1
O2(g)= C4H8(g)+H2O(g) ΔH2=-119 kJ·mol-1
③H2(g)+ ![]() O2(g)= H2O(g) ΔH3=-242 kJ·mol-1
O2(g)= H2O(g) ΔH3=-242 kJ·mol-1
反应①的ΔH1为________ kJ·mol-1。图(a)是反应①平衡转化率与反应温度及压强的关系图,x_____________0.1(填“大于”或“小于”);欲使丁烯的平衡产率提高,应采取的措施是__________(填标号)。
A.升高温度 B.降低温度 C.增大压强 D.降低压强

(2)丁烷和氢气的混合气体以一定流速通过填充有催化剂的反应器(氢气的作用是活化催化剂),出口气中含有丁烯、丁烷、氢气等。图(b)为丁烯产率与进料气中n(氢气)/n(丁烷)的关系。图中曲线呈现先升高后降低的变化趋势,其降低的原因是___________。
(3)图(c)为反应产率和反应温度的关系曲线,副产物主要是高温裂解生成的短碳链烃类化合物。丁烯产率在590℃之前随温度升高而增大的原因可能是___________、____________;590℃之后,丁烯产率快速降低的主要原因可能是_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将1molCH4和适量的氧气在密闭容器中点燃,充分反应后,甲烷和氧气均无剩余,且产物均为气体(101kPa,120℃),其总质量为72g,下列有关叙述不正确的是( )
A.若将产物通过碱石灰,则可全被吸收,若通过浓硫酸,则不能被完全吸收
B.产物的平均摩尔质量为24g/mol
C.若将产物通过浓硫酸充分吸收后恢复至(101kPa,120℃),则体积变为原来的![]()
D.反应中消耗的氧气为1.75mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用如图装置可验证同主族元素非金属性的变化规律。
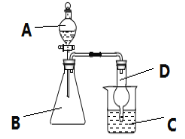
(1)若要证明非金属性:Cl>I,则A中加浓盐酸,B中加KMnO4,(KMnO4与浓盐酸常温下反应生成氯气),C中加淀粉碘化钾混合溶液,观察到C中溶液___的现象,即可证明。从环保角度考虑,此装置缺少尾气处理装置,可用___溶液吸收尾气。请写出一种制氯气的化学反应方程式:___。
(2)若要证明非金属性:C>Si,则在A中加盐酸、B中加CaCO3、C中加Na2SiO3溶液,观察到C中溶液___的现象,即可证明。但有的同学认为盐酸具有挥发性,可进入C中干扰实验,应在两装置间添加装有___溶液的洗气瓶。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】最近罗格斯大学研究人员利用电催化技术高效率将CO2转化为X和Y(如下图), X、Y可用作制备塑料、粘合剂和药品的前体等。下列说法正确的是
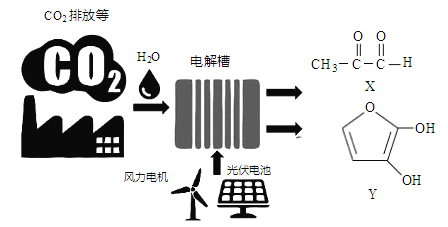
A. 图中能量转换方式只有2种
B. X、Y分子中所含的官能团相同
C. X、Y均是电解时的阳极产物
D. CO2资源化利用有利于解决大气中CO2浓度增加导致的环境问题
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,向![]() 浓度均为
浓度均为![]() 和
和![]() 的混合溶液中滴加
的混合溶液中滴加![]() 的
的![]() ,测得混合溶液的电阻率(溶液的电阻率越大,导电能力越弱)与加入氨水的体积
,测得混合溶液的电阻率(溶液的电阻率越大,导电能力越弱)与加入氨水的体积![]() 的关系如图所示(忽略混合时体积变化),下列说法正确的是( )
的关系如图所示(忽略混合时体积变化),下列说法正确的是( )

A.常温下,![]() 的
的![]() 比同浓度
比同浓度![]() 的
的![]() 大
大
B.![]() 过程中水的电离程度先减小后增大
过程中水的电离程度先减小后增大
C.![]() 点溶液中,
点溶液中,![]()
D.![]() 点时,
点时,![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲醇是一种可再生能源,具有广阔的开发和应用前景,可用![]() 等作为催化剂,采用如下反应来合成甲醇:
等作为催化剂,采用如下反应来合成甲醇:![]()
(1)下表是有关化学键的键能数据,计算表中的a=__________。
化学键 |
|
|
|
|
|
键能 | 436 | 462.8 | a | 1075 | 351 |
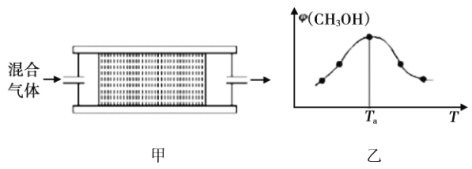
(2)将![]() 的混合气体,匀速通过装有催化剂的反应器反应(如图甲),反应器温度变化与从反应器排出气体中
的混合气体,匀速通过装有催化剂的反应器反应(如图甲),反应器温度变化与从反应器排出气体中![]() 的体积分数φ关系如图乙,φ(CH3OH)变化的原因是__________。
的体积分数φ关系如图乙,φ(CH3OH)变化的原因是__________。
(3)某学习小组模拟工业合成甲醇的反应,在![]() 的恒容密闭容器内充入
的恒容密闭容器内充入![]() 和
和![]() ,加入合适催化剂后在某温度下开始反应,并用压力计监测容器内压强的变化如表:
,加入合适催化剂后在某温度下开始反应,并用压力计监测容器内压强的变化如表:
反应时间/min | 0 | 5 | 10 | 15 | 20 | 25 |
压强/MPa | 12.6 | 10.8 | 9.5 | 8.7 | 8.4 | 8.4 |
从反应开始到![]() 时,
时,![]() 的平均反应速率为______,该温度下的平衡常数
的平均反应速率为______,该温度下的平衡常数![]() 为______。
为______。
(4)另将![]() 和
和![]() 加入密闭容器中,在一定条件下发生上述反应。平衡时
加入密闭容器中,在一定条件下发生上述反应。平衡时![]() 的体积分数(%)与温度和压强的关系如图所示(虚线框表示没有测定该条件下的数据)。
的体积分数(%)与温度和压强的关系如图所示(虚线框表示没有测定该条件下的数据)。
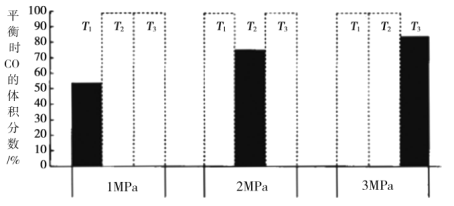
![]() 由大到小的关系是__________,判断理由是__________。
由大到小的关系是__________,判断理由是__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图为碘晶体晶胞结构。有关说法中正确的是( )
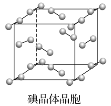
A. 碘晶体为无限延伸的空间结构,是原子晶体
B. 用切割法可知平均每个晶胞中有4个碘原子
C. 碘晶体中的碘原子间存在非极性键和范德华力
D. 碘分子的排列有2种不同的取向,2种取向不同的碘分子以4配位数交替配位形成层结构
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com