
【题目】最近罗格斯大学研究人员利用电催化技术高效率将CO2转化为X和Y(如下图), X、Y可用作制备塑料、粘合剂和药品的前体等。下列说法正确的是
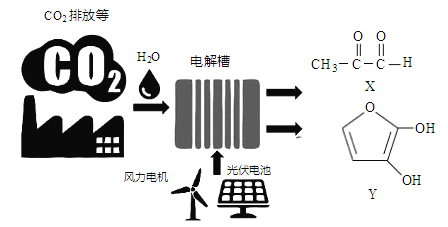
A. 图中能量转换方式只有2种
B. X、Y分子中所含的官能团相同
C. X、Y均是电解时的阳极产物
D. CO2资源化利用有利于解决大气中CO2浓度增加导致的环境问题
 期末1卷素质教育评估卷系列答案
期末1卷素质教育评估卷系列答案科目:高中化学 来源: 题型:
【题目】(1)标况下11gCO2的物质的量为___,体积为___。
(2)已知4.8g某混合气体含分子数为0.15NA,该气体的平均摩尔质量为___。
(3)等物质的量的SO2和SO3含有的氧原子个数比为____;气体的质量比为___。
(4)12gCH4和O2的混合气体在标准状况下的体积为11.2L,则混合气体中CH4与O2的物质的量之比为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关实验操作、现象和解释或结论都正确的是
选项 | 实验操作 | 现象 | 解释或结论 |
A | 过量的Fe粉中加入稀HNO3,充分反应后,滴入KSCN溶液 | 溶液呈红色 | 稀HNO3将Fe氧化为Fe3+ |
B |
| 左边棉球变为橙色,右边棉球变为蓝色 | 氧化性.Cl2>Br2>I2 |
C | 用玻璃棒蘸取浓氨水点到红色石蕊试纸上 | 试纸变蓝色 | 浓氨水呈碱性 |
D | 浓HNO3加热 | 有红棕色气体 | HNO3有强氧化性 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列原子构成的单质中既能与稀硫酸反应,又能与烧碱溶液反应,且都产生H2的是
A. 核内无中子的原子
B. 外围电子构型为3s23p4的原子
C. 核外电子排布图为![]()
![]() 的基态原子
的基态原子
D. 处于激发态时其原子的电子排布式可能为1s22s22p63s13p2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设![]() 为阿伏加德罗常数的值。化工厂常用浓氨水来检验氯气管道是否发生泄漏,其原理是:
为阿伏加德罗常数的值。化工厂常用浓氨水来检验氯气管道是否发生泄漏,其原理是:![]() 。下列说法正确的是( )
。下列说法正确的是( )
A.如果氯气管道漏气,则会看到有大量白雾生成
B.反应中每形成![]() 键,转移电子数为
键,转移电子数为![]()
C.![]() 的
的![]() 溶液中,
溶液中,![]() 的数目小于
的数目小于![]()
D.该反应中,氧化剂与还原剂的物质的量之比为![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关实验现象和解释或结论都正确的是( )
选项 | 实验操作 | 现象 | 解释或结论 |
A | 取硫酸催化淀粉水解的反应液,滴入少量新制 | 有砖红色沉淀生成 | 葡萄糖具有还原性 |
B |
| 有白色絮状沉淀生成 | 二者水解相互促进生成氢氧化铝沉淀 |
C | 将充满 | 红棕色变深 | 反应 |
D | 向 | 得到红褐色透明液体 | 得到 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. 燃料电池化学能100%转化为电能
B. 酶催化发生的反应,温度越高化学反应速率一定越快
C. 为减缓浸入海水中的钢铁水闸的腐蚀,可在其表面镶上铜锭
D. 向0.1mol/L氨水中加入少量水,溶液中![]() 增大
增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Na2S可用于制造硫化染料、沉淀水体中的重金属等。
(1)Na2S溶液中S2-水解的离子方程式为_________。
(2)室温时,几种重金属离子的硫化物的溶度积常数如下表:
金属硫化物 | FeS | PbS | CuS | HgS |
Ksp | 6.3×10-18 | 1.0×10-28 | 6.3×10-36 | 1.6×10-52 |
①向物质的量浓度相同的Fe2+、Pb2+、Cu2+、Hg2+的混合稀溶液中,逐滴加入Na2S稀溶液,首先沉淀的离子是____。
②用Na2S溶液沉淀废水中Pb2+,为使Pb2+沉淀完全[c(Pb2+)≤1×10-6mol/L],则应满足溶液中c(S2-)≥_____mol/L。
③反应Cu2+(aq)+FeS(s)![]() Fe2+(aq)+CuS(s)的平衡常数K=_______。
Fe2+(aq)+CuS(s)的平衡常数K=_______。
(3)测定某Na2S和NaHS混合样品中两者含量的实验步骤如下:
步骤1.准确称取一定量样品于烧杯中,加入少量蒸馏水溶解,转移至500mL容量瓶中定容。
步骤2.准确移取25.00mL上述溶液于锥形瓶中,加入茜素黄GG-百时香酚蓝混合指示剂,用0.2500mol/L盐酸标准溶液滴定(Na2S+HCl=NaHS+NaCl)至终点,消耗盐酸24.00mL;向其中再加入5mL中性甲醛(NaHS+HCHO+H2O→NaOH+HSCH2OH)和3滴酚酞指示剂,继续用0.2500mol/L盐酸标准溶液滴定(NaOH+HCl=NaCl+H2O)至终点,又消耗盐酸34.00mL。
计算原混合物中Na2S与NaHS的物质的量之比(写出计算过程)___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是实验室制取SO2并验证SO2某些性质的装置图。若观察到装置④中的有淡黄色沉淀生成,⑤中的溴水褪色(已知因含有Br2而溴水呈红棕色),请回答:
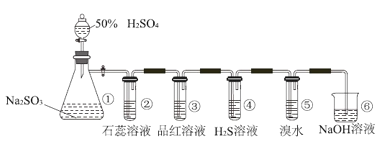
(1)①中发生反应的离子方程式为_____。
(2)③的实验现象是_____,证明SO2有_____性。
(3)④中SO2做_____剂。
(4)⑤中反应生成两种强酸,该反应的离子方程式是_____。
(5)⑥的作用是_____。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com