
【题目】下列有关实验操作、现象和解释或结论都正确的是
选项 | 实验操作 | 现象 | 解释或结论 |
A | 过量的Fe粉中加入稀HNO3,充分反应后,滴入KSCN溶液 | 溶液呈红色 | 稀HNO3将Fe氧化为Fe3+ |
B |
| 左边棉球变为橙色,右边棉球变为蓝色 | 氧化性.Cl2>Br2>I2 |
C | 用玻璃棒蘸取浓氨水点到红色石蕊试纸上 | 试纸变蓝色 | 浓氨水呈碱性 |
D | 浓HNO3加热 | 有红棕色气体 | HNO3有强氧化性 |
A. A B. B C. C D. D
 阳光课堂课时优化作业系列答案
阳光课堂课时优化作业系列答案科目:高中化学 来源: 题型:
【题目】晶体硅是一种重要的非金属材料,制备纯硅的主要步骤如下:
①高温下用碳还原二氧化硅制得粗硅
②粗硅与干燥HCl气体反应制得SiHCl3: Si+3HC1![]() SiHCl3+H2
SiHCl3+H2
③SiHCl3与过量H2在1000~1100℃反应制得纯硅。已知SiHCl3能与H2O强烈反应,在空气中易自燃。
请回答下列问题:
(1)①中制取粗硅的化学方程式:_____________________。
(2)粗硅与HCl 反应完全后,经冷凝得到的SiHCl3 (沸点33.0℃) 中含有少量SiCl4(沸点57.6℃)和HCl(沸点-84.7℃),提纯SiHCl3采用的方法为______________。
(3)用SiHCl3与过量H2反应制备纯硅的装置如下(热源及夹持装置略去):
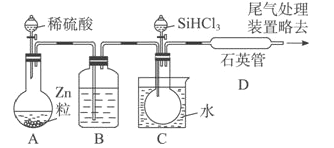
①装置B中的试剂是浓硫酸。装置C 中的烧瓶需要加热,其目的是____________。
②装置D中发生反应的化学方程式为____________。
③为鉴定产品硅中是否含微量铁单质,将试样用稀盐酸溶解,取上层清液后需再加入的试剂(填写字母代号)是____________。
a.碘水 b.氯水 c.NaOH溶液 d.KSCN 溶液 e.Na2SO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在下列中学化学中常见物质的转化关系图中,已知常温下A为淡黄色固体化合物、B为金属单质,D、E、M是常见气体单质,其中I为红褐色固体,M为黄绿色,N是胃酸的主要成分,工业上用E和M来制取N,试推断:
(1)写出下列化学式AI
(2)G转化为I的现象为
(3)F+M→H离子方程式为
(4)A+X→C+D的化学方程式为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组同学展开对漂白剂亚氯酸钠(NaClO2)的研究。

已知:①NaClO2饱和溶液在温度低于38℃时析出晶体是NaClO23H2O,高于38℃时析出晶体是NaClO2,高于60℃时NaClO2分解成NaClO3和NaCl;
②二氧化氯极易溶于水。
(1)装置A中NaClO3和Na2SO3制备ClO2气体,其物质的量的理论比值为____________;该装置中采用浓硫酸而不用稀硫酸的原因是___________。
(2)装置B的作用是 _____________;装置C中反应为放热反应,在不改变反应物浓度和体积的条件下,为了使反应在低温下进行,实验中可采取的措施是________________。
(3)写出装置C发生的离子方程式______________。
(4)从装置C反应后的溶液获得干燥的NaClO2晶体的操作步骤为:将装置C中的液体取出在减压和55℃条件下蒸发,至出现大量晶体后,___________________(填实验步骤)。(已知:NaClO2晶体易溶于水,难溶解于乙醇等有机溶剂。)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某盐的溶液中含有Na+、Mg2+、Cl-、SO42-四种离子,若Na+为0.1mol,Mg2+为0.3mol,Cl-为0.3mol,则SO42-物质的量为( )
A.0.1 molB.0.3molC.0.2molD.0.5mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于氯化钠溶液、Fe(OH)3胶体和泥水三种分散系,下列叙述正确的是
A.Fe(OH)3胶体能产生丁达尔效应
B.最稳定的分散系是Fe(OH)3胶体
C.氯化钠溶液和Fe(OH)3胶体中的分散质都能透过半透膜
D.Fe(OH)3胶体的分散质粒子直径均小于1nm
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CuCl晶体微溶于水和稀硫酸,不溶于乙醇,但易溶于浓盐酸和氯化铵溶液,发生的反应为:CuCl+Cl-![]() CuC12,且其见光易分解,露置于潮湿空气中易被氧化。回答下列问题:
CuC12,且其见光易分解,露置于潮湿空气中易被氧化。回答下列问题:
(1)实验室保存新制CuCl晶体的方法是__________。
(2)向硫酸铜溶液中加入亚硫酸铵和氯化铵,会发生反应生成CuCl。
①该反应的离子方程式为_____________。
②(NH4)2SO3要适当过量,目的为保证Cu2+的还原速率、_____________。
③已知Cu2+的沉淀率与NH4Cl、CuSO4的物质的量之比[n(NH4Cl)/n(CuSO4)]的关系如图甲所示,当氯化铵用量增加到一定程度后,Cu2+的沉淀率减小,原因是_______________。

(3)已知:CuCl固体、CuOH固体分别为白色和橙黄色,且Ksp(CuCl)=1.2×10-6,Ksp(CuOH)=1.2×10-14。用铜电极电解饱和食盐水的装置如图乙所示,阳极的电极反应式为Cu-e-+Cl-=CuCl。则实验过程中的实验现象为_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验操作、现象及得出的结论均正确的是
选项 | 实验操作 | 现象 | 结论 |
A | 向盛有品红的两只试管中分别通入SO2和Cl2 | 品红均褪色 | 两者漂白原理相同 |
B | 向体积相同且pH均为3.3的一元酸HX和HY中分别加入足量锌粒 | 产生的H2前者比后者多 | HX、HY均是弱酸 |
C | 在难溶性FeS和CuS中分别加入0.3mol/L盐酸 | 前者溶解,后者不溶 | Ksp(FeS)>Ksp(CuS) |
D | 向盛有相同体积、10%H2O2溶液的两只试管中分别加入足量酸性KMnO4溶液和FeCl3溶液 | 前者产生的气体多 | KMnO4催化活性比FeCl3高 |
A. A B. B C. C D. D
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com