
【题目】设![]() 为阿伏加德罗常数的值。化工厂常用浓氨水来检验氯气管道是否发生泄漏,其原理是:
为阿伏加德罗常数的值。化工厂常用浓氨水来检验氯气管道是否发生泄漏,其原理是:![]() 。下列说法正确的是( )
。下列说法正确的是( )
A.如果氯气管道漏气,则会看到有大量白雾生成
B.反应中每形成![]() 键,转移电子数为
键,转移电子数为![]()
C.![]() 的
的![]() 溶液中,
溶液中,![]() 的数目小于
的数目小于![]()
D.该反应中,氧化剂与还原剂的物质的量之比为![]()
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】氢化锂(LiH)在干燥的空气中能稳定存在,遇水或酸剧烈反应,能够引起燃烧。某化学科研小组准备使用下列装置制备LiH固体。下列说法正确的是
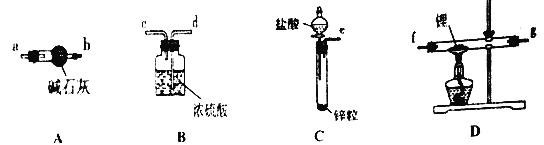
A. 上述仪器装置按气流从左到右连接顺序为:e接d,c接f,g接a,b(和g调换也可以)
B. 实验中所用的金属锂保存在煤油中
C. 在加热D处的石英管之前,应先通入一段时间氢气,排尽装置内的空气
D. 干燥管中的碱石灰可以用无水CaCl2代替
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z三种短周期元素在周期表中的位置如图,X通过共用三对电子形成X2分子,下列说法不正确的是( )
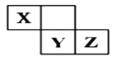
A.化合物XZ3中各原子均满足8电子的稳定结构
B.X、Y、Z三种元素形成的含氧酸都是强酸
C.常温下,Z单质可与Y的氢化物发生置换反应
D.X2分子内部含有三键,所以X2性质比较稳定
查看答案和解析>>
科目:高中化学 来源: 题型:
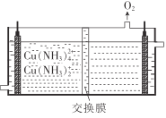
【题目】氯化亚铜是一种重要的化工产品,广泛用于颜料、电镀和有机合成等方面。它不溶于H2SO4和醇,微溶于水,可溶于浓盐酸和氨水,在潮湿空气中易水解且被氧化成绿色的碱式氯化铜[Cu(OH)C1]。以海绵铜(主要成分是Cu,还含少量CuO)为原料,采用硝酸铵氧化分解技术生产CuCl的工艺流程如图:
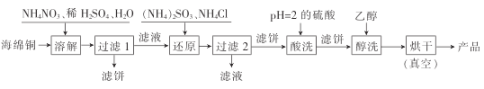
回答下列问题:
(1)为了提高“溶解”速率,工业生产中宜采用的措施有__(答两条即可)。
(2)写出“溶解”过程中发生氧化还原反应的离子方程式:__。
(3)“过滤2”所得滤液经蒸发浓缩、冷却结晶、过滤等操作获得一种化学肥料,它的主要成分是__(填化学式)。
(4)工业生产中,用pH=2的硫酸洗涤“产品”,其目的是__。
(5)氯化亚铜产率与温度、溶液pH的关系如图所示。据图分析,流程化生产氯化亚铜的过程中,温度过低会影响CuCl产率的原因是__;温度过高、pH过大也会影响CuCl产率的原因是__。
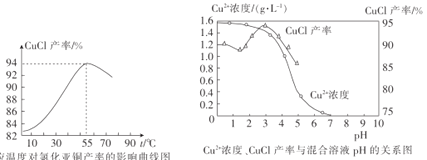
(6)目前利用膜电解再生氨性含铜蚀刻废液制备氯化亚铜的技术获得突破。首先在电解槽中电解氨性含铜蚀刻废液,电解后向阴极液中加入盐酸酸化,再倒入蒸馏水稀释得到氯化亚铜沉淀。电解装置如图所示,阴极区发生的电极反应为__,阳极区溶液的pH将__(填“变大”或“变小”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下将3molA及3molB混合于2L的密闭容器中,发生如下反应3A(g)+B(g)![]() xC(g)+2D(g),经过5分钟后反应达到平衡,测得A的转化率为60%,C的平均反应速率是0.18mol/(Lmin)。求:
xC(g)+2D(g),经过5分钟后反应达到平衡,测得A的转化率为60%,C的平均反应速率是0.18mol/(Lmin)。求:
(1)平衡时B的浓度=___mol/L。
(2)D的平均反应速率v(D)=___mol/(L·min)。
(3)x=___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】最近罗格斯大学研究人员利用电催化技术高效率将CO2转化为X和Y(如下图), X、Y可用作制备塑料、粘合剂和药品的前体等。下列说法正确的是
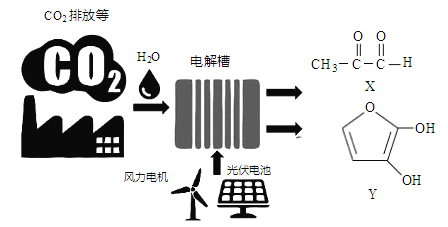
A. 图中能量转换方式只有2种
B. X、Y分子中所含的官能团相同
C. X、Y均是电解时的阳极产物
D. CO2资源化利用有利于解决大气中CO2浓度增加导致的环境问题
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,下列各组离子在指定溶液中能大量共存的是
A. 0.1mol/LFeCl3溶液:NH4+、K+、SCN-、NO3-
B. ![]() =0.1mol/L的溶液:K+、Cu2+、Br-、SO42-
=0.1mol/L的溶液:K+、Cu2+、Br-、SO42-
C. 能使甲基橙变红的溶液:Ca2+、NH4+、CH3COO-、Cl-
D. 由水电离产生的c(H+)=1×10-13mol/L的溶液:Na+、K+、Cl-、NO3-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在两个容积均为2L恒温密闭容器中,起始时均充入amolH2S,控制不同温度和分别在有、无Al2O3催化时进行H2S的分解实验[反应为:2H2S(g)![]() 2H2(g)+S2(g)]。测得的结果如下图所示(曲线Ⅱ、Ⅲ表示经过相同时间且未达到化学平衡时H2S的转化率)。
2H2(g)+S2(g)]。测得的结果如下图所示(曲线Ⅱ、Ⅲ表示经过相同时间且未达到化学平衡时H2S的转化率)。
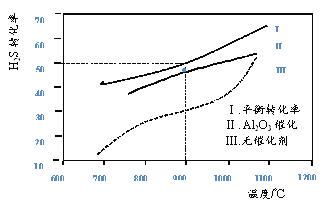
下列说法不正确的是
A. H2S分解为放热反应
B. 加入Al2O3 可提高H2S的平衡转化率
C. 900℃反应2H2S(g)![]() 2H2(g)+S2(g)的平衡常数K=0.125a
2H2(g)+S2(g)的平衡常数K=0.125a
D. 约1100℃曲线Ⅱ、Ⅲ几乎重合,说明Al2O3可能几乎失去催化活性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物Q是有机合成的重要中间体,制备Q的一种合成路线如下(部分反应条件和试剂略去)。
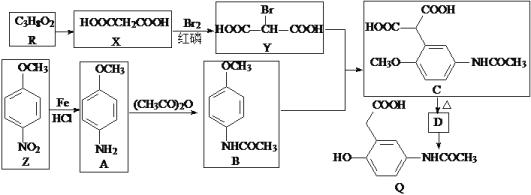
回答下列问题:
(1)Y中不含氧的官能团名称为__________,R的名称为_________________________。
(2)加热C脱去CO2生成D,D的结构简式为____________________________。
(3)B+Y→C的反应类型是_______________,Q的分子式为____________________。
(4)A→B的化学方程式为______________________________________________。
(5)同时满足下列条件的Z的同分异构体有_____________种(不包括立体异构)。①能与氯化铁溶液发生显色反应;②能与碳酸氢钠反应;③含―NH2; ④苯环上有处于对位的取代基
(6)已知:―NH2具有强还原性。参照上述合成路线,以![]() 为原料(无 机试剂任选),设计制备
为原料(无 机试剂任选),设计制备![]() 的合成路线:__________。(格式:CH2=CH2
的合成路线:__________。(格式:CH2=CH2![]() CH3CH2Br
CH3CH2Br![]() CH3CH2OH)
CH3CH2OH)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com