
【题目】一定温度下将3molA及3molB混合于2L的密闭容器中,发生如下反应3A(g)+B(g)![]() xC(g)+2D(g),经过5分钟后反应达到平衡,测得A的转化率为60%,C的平均反应速率是0.18mol/(Lmin)。求:
xC(g)+2D(g),经过5分钟后反应达到平衡,测得A的转化率为60%,C的平均反应速率是0.18mol/(Lmin)。求:
(1)平衡时B的浓度=___mol/L。
(2)D的平均反应速率v(D)=___mol/(L·min)。
(3)x=___。
【答案】1.2mol/L 0.12mol/(L·min) 3
【解析】
根据题意,A的转化率为60%,则A的转化量=3mol×60%=1.8mol,利用各物质的转化量之比等于化学计量数之比,列出三段式解答:
 。
。
(1)由三段式可知,平衡时B的物质的量为2.4mol,则其浓度c=n/V=2.4mol÷2L=1.2mol/L;
(2) v(D)=Δc(D)/Δt=1.2mol÷(2L×5min)= 0.12mol/(L·min);
(3)同一反应中各物质的速率之比等于化学计量数之比,则v(C) :v(D)=x:2,代入数据,0.18mol/(L·min):0.12mol/(L·min)= x:2,x=3。


科目:高中化学 来源: 题型:
【题目】某气态烃A在标准状况下的密度为1.25g/L,其产量可以用来衡量一个国家的石油化工发展水平。B和D都是生活中常见的有机物,D能跟碳酸氢钠反应。它们之间的转化关系如下图所示:

(1)A的结构式为___; F的结构简式为___;D中官能团的名称为___。
(2)反应①的反应类型是____,反应③的化学方程式为________。
(3)反应②在Cu做催化剂的条件下进行,该实验的步骤是将红亮的铜丝置于酒精灯上加热,待铜丝变为黑色时,迅速将其插入到装有B的试管中 (如图所示)。

重复操作2-3次,观察到的现象是___,该反应的化学方程式为______。
(4)B和D在浓硫酸的作用下实现反应④,实验装置如下图所示:

实验开始前饱和X溶液的溶质是_________;
饱和X溶液的作用是:___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】正硼酸(H3BO3)是一种片层状结构的白色晶体,层内的H3BO3分子之间通过氢键相连(层状结构如图所示,图中‘‘虚线”表示氢键)。下列有关说法正确的是

A. H3BO3分子的稳定性与氢键有关
B. 含1 molH3BO3的晶体中有3 mol氢键
C. 分子中B、O最外层均为8e-稳定结构
D. B原子杂化轨道的类型为sp2,同层分子间的主要作用力是范德华力
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯化亚硝酰(NOCl,沸点为-5.5℃)是有机合成中的重要试剂,为黄色气体,具有刺鼻恶臭味,遇水反应,有多种方法制备氯化亚硝酰。已知:HNO2既有氧化性又有还原性,AgNO2微溶于水,溶于硝酸:AgNO2+HNO3=AgNO3+HNO2。
(1)将5g在300℃下干燥了3h并研细的KCl粉末装入50mL带有接头及抽真空用活塞的玻璃容器内。将容器尽量减压,在减压条件下通入0.002molNO2。反应12~36min即可完成,红棕色的NO2消失,出现黄色的氯化亚硝酰,同时还得到一种盐,该盐的化学式为_。氯化钾需要“干燥”的原因是__。
(2)实验室可由氯气与一氧化氮在常温常压下合成氯化亚硝酰,装置如图所示。

①仪器a的名称为__。
②干燥管中盛放的试剂为_。
③生成NOCl的化学方程式为__。
(3)为验证NOCl与H2O反应后的溶液中存在Cl-和HNO2,设计如下实验步骤,完成下列表格。
步骤 | 实验现象或反应的化学方程式 |
①取5mL仪器a中产品,加入盛有水的烧杯中,充分反应 | NOCl与H2O反应的化学方程式为__ |
②向烧杯中滴加足量AgNO3溶液,有白色沉淀生成,再加入足量稀硝酸 | 加入稀硝酸后,实验现象为__ |
③向步骤②烧杯中滴加酸性KMnO4溶液 | 实验现象为_ |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据化学能和热能、电能相关的知识,请回答下列问题:
I.已知31 g白磷(P4)变为31 g红磷(P)时释放能量。上述变化属于_____变化;稳定性白磷_____红磷(填“>”或“<”);
II.氢气是一种清洁能源,在我国航天工程中也有应用。
(1)已知:2H2+O2![]() 2H2O。该反应1g氢气完全燃烧放出热量121kJ,其中断裂1molH—H键吸收436kJ,断裂1molO=O键吸收496kJ,那么形成1molH—O键放出热量_______________。
2H2O。该反应1g氢气完全燃烧放出热量121kJ,其中断裂1molH—H键吸收436kJ,断裂1molO=O键吸收496kJ,那么形成1molH—O键放出热量_______________。
(2)航天技术上使用的氢-氧燃料电池原理可以简单看作下图“氢-氧燃料电池的装置图” 则:

①a极为电池的______(填“正极”或“负极”);溶液中OH-移向_______电极(填“a”或“b”)。
②b电极附近pH_______。(填增大、减小或不变)。
③如把H2改为甲烷,则电极反应式为:负极_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设![]() 为阿伏加德罗常数的值。化工厂常用浓氨水来检验氯气管道是否发生泄漏,其原理是:
为阿伏加德罗常数的值。化工厂常用浓氨水来检验氯气管道是否发生泄漏,其原理是:![]() 。下列说法正确的是( )
。下列说法正确的是( )
A.如果氯气管道漏气,则会看到有大量白雾生成
B.反应中每形成![]() 键,转移电子数为
键,转移电子数为![]()
C.![]() 的
的![]() 溶液中,
溶液中,![]() 的数目小于
的数目小于![]()
D.该反应中,氧化剂与还原剂的物质的量之比为![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】![]() 和
和![]() 为原子序数依次增大的短周期元素,
为原子序数依次增大的短周期元素,![]() 同主族且能形成离子化合物,
同主族且能形成离子化合物,![]() 的最外层电子数是
的最外层电子数是![]() 质子数之和的一半,
质子数之和的一半,![]() 原子的核外电子数为偶数。四种元素组成的一种化合物
原子的核外电子数为偶数。四种元素组成的一种化合物![]() 具有下列性质。下列说法正确的是( )
具有下列性质。下列说法正确的是( )
白色沉淀![]() M
M![]() 溶液褪色并产生气泡
溶液褪色并产生气泡
A.原子半径:![]()
B.![]() 使溴水褪色体现氧化性
使溴水褪色体现氧化性
C.简单氢化物的稳定性:![]()
D.![]() 与
与![]() 均能形成具有漂白性的物质
均能形成具有漂白性的物质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁、铜及其化合物应用广泛。回答下列问题:
(1)基态铁原子核外最后一个电子填充在__________(填能级符号),含有__________个成单电子,具有磁性。
(2)铁氰化钾![]() 是检验
是检验![]() 的重要试剂。
的重要试剂。
①铁氰化钾中,所涉及的元素的第一电离能由大到小的顺序为__________。
②铁氰化钾中,不存在__________(填字母标号)。
A.离子键 B.σ键 C.π键 D.氢键 E.金属键
(3)血蓝蛋白是某些节肢动物体内能与氧气可逆结合的一种铜蛋白,其部分结构示意图如图。其中![]() 的化合价为_______价,
的化合价为_______价,![]() 的杂化类型是__________。
的杂化类型是__________。
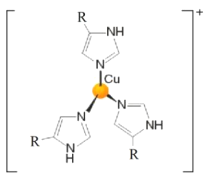
(4)![]() 合金可看作由如图所示的(a)、(b)两种原子层交替堆积排列而成。图中虚线构建的六边形,表示由这两种层平行堆积时垂直于层的相对位置;(c)是由(a)和(b)两种原子层交替堆积成
合金可看作由如图所示的(a)、(b)两种原子层交替堆积排列而成。图中虚线构建的六边形,表示由这两种层平行堆积时垂直于层的相对位置;(c)是由(a)和(b)两种原子层交替堆积成![]() 合金的晶体结构图。在这种结构中,同一层的
合金的晶体结构图。在这种结构中,同一层的![]() 距离为
距离为![]() 。
。

①![]() 合金中
合金中![]() __________。
__________。
②同一层中,![]() 原子之间的最短距离是__________
原子之间的最短距离是__________![]() ,设
,设![]() 为阿伏加德罗常数的值,若要求算
为阿伏加德罗常数的值,若要求算![]() 晶体的密度,还需要知道的物理量是_________(钙、铜元素的相对原子质量为已知量)。
晶体的密度,还需要知道的物理量是_________(钙、铜元素的相对原子质量为已知量)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据物质结构有关性质和特点,回答下列问题:
(1)Ti基态原子核外电子排布式为____________,碳原子的价电子轨道表示式为________。
(2)钛存在两种同素异形体,α—Ti采纳六方最密堆积,β—Ti采纳体心立方堆积,由α—Ti转变为β—Ti晶体体积____________(填“膨胀”或“收缩”)。
(3)写出一种与NH4+互为等电子体物质的化学式____________。
(4)SO2的空间构型为___________________。
(5)丙烯腈(CH2=CH—CN)分子中σ键和π键的个数比为____,分子中碳原子轨道杂化类型是______。
(6)FeCl3熔点282℃,而FeCl2熔点674℃,二者熔点差异的原因是______________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com