
【题目】室温下,下列各组离子在指定溶液中能大量共存的是
A. 0.1mol/LFeCl3溶液:NH4+、K+、SCN-、NO3-
B. ![]() =0.1mol/L的溶液:K+、Cu2+、Br-、SO42-
=0.1mol/L的溶液:K+、Cu2+、Br-、SO42-
C. 能使甲基橙变红的溶液:Ca2+、NH4+、CH3COO-、Cl-
D. 由水电离产生的c(H+)=1×10-13mol/L的溶液:Na+、K+、Cl-、NO3-
科目:高中化学 来源: 题型:
【题目】已知A是一种常见金属,F是一种红褐色沉淀。试根据图中转化关系,回答下列问题。

(1)写出F、G的化学式。F:__,G:___。
(2)检验D中阳离子的方法___。
(3)保存C溶液时为什么要加固体A__。
(4)写出下列转化的离子方程式或化学方程式。
①A→C:___。
②C→D:___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯化亚硝酰(NOCl,沸点为-5.5℃)是有机合成中的重要试剂,为黄色气体,具有刺鼻恶臭味,遇水反应,有多种方法制备氯化亚硝酰。已知:HNO2既有氧化性又有还原性,AgNO2微溶于水,溶于硝酸:AgNO2+HNO3=AgNO3+HNO2。
(1)将5g在300℃下干燥了3h并研细的KCl粉末装入50mL带有接头及抽真空用活塞的玻璃容器内。将容器尽量减压,在减压条件下通入0.002molNO2。反应12~36min即可完成,红棕色的NO2消失,出现黄色的氯化亚硝酰,同时还得到一种盐,该盐的化学式为_。氯化钾需要“干燥”的原因是__。
(2)实验室可由氯气与一氧化氮在常温常压下合成氯化亚硝酰,装置如图所示。

①仪器a的名称为__。
②干燥管中盛放的试剂为_。
③生成NOCl的化学方程式为__。
(3)为验证NOCl与H2O反应后的溶液中存在Cl-和HNO2,设计如下实验步骤,完成下列表格。
步骤 | 实验现象或反应的化学方程式 |
①取5mL仪器a中产品,加入盛有水的烧杯中,充分反应 | NOCl与H2O反应的化学方程式为__ |
②向烧杯中滴加足量AgNO3溶液,有白色沉淀生成,再加入足量稀硝酸 | 加入稀硝酸后,实验现象为__ |
③向步骤②烧杯中滴加酸性KMnO4溶液 | 实验现象为_ |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设![]() 为阿伏加德罗常数的值。化工厂常用浓氨水来检验氯气管道是否发生泄漏,其原理是:
为阿伏加德罗常数的值。化工厂常用浓氨水来检验氯气管道是否发生泄漏,其原理是:![]() 。下列说法正确的是( )
。下列说法正确的是( )
A.如果氯气管道漏气,则会看到有大量白雾生成
B.反应中每形成![]() 键,转移电子数为
键,转移电子数为![]()
C.![]() 的
的![]() 溶液中,
溶液中,![]() 的数目小于
的数目小于![]()
D.该反应中,氧化剂与还原剂的物质的量之比为![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】![]() 和
和![]() 为原子序数依次增大的短周期元素,
为原子序数依次增大的短周期元素,![]() 同主族且能形成离子化合物,
同主族且能形成离子化合物,![]() 的最外层电子数是
的最外层电子数是![]() 质子数之和的一半,
质子数之和的一半,![]() 原子的核外电子数为偶数。四种元素组成的一种化合物
原子的核外电子数为偶数。四种元素组成的一种化合物![]() 具有下列性质。下列说法正确的是( )
具有下列性质。下列说法正确的是( )
白色沉淀![]() M
M![]() 溶液褪色并产生气泡
溶液褪色并产生气泡
A.原子半径:![]()
B.![]() 使溴水褪色体现氧化性
使溴水褪色体现氧化性
C.简单氢化物的稳定性:![]()
D.![]() 与
与![]() 均能形成具有漂白性的物质
均能形成具有漂白性的物质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. 燃料电池化学能100%转化为电能
B. 酶催化发生的反应,温度越高化学反应速率一定越快
C. 为减缓浸入海水中的钢铁水闸的腐蚀,可在其表面镶上铜锭
D. 向0.1mol/L氨水中加入少量水,溶液中![]() 增大
增大
查看答案和解析>>
科目:高中化学 来源: 题型:
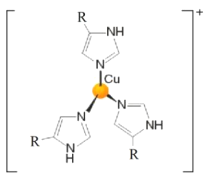
【题目】铁、铜及其化合物应用广泛。回答下列问题:
(1)基态铁原子核外最后一个电子填充在__________(填能级符号),含有__________个成单电子,具有磁性。
(2)铁氰化钾![]() 是检验
是检验![]() 的重要试剂。
的重要试剂。
①铁氰化钾中,所涉及的元素的第一电离能由大到小的顺序为__________。
②铁氰化钾中,不存在__________(填字母标号)。
A.离子键 B.σ键 C.π键 D.氢键 E.金属键
(3)血蓝蛋白是某些节肢动物体内能与氧气可逆结合的一种铜蛋白,其部分结构示意图如图。其中![]() 的化合价为_______价,
的化合价为_______价,![]() 的杂化类型是__________。
的杂化类型是__________。
(4)![]() 合金可看作由如图所示的(a)、(b)两种原子层交替堆积排列而成。图中虚线构建的六边形,表示由这两种层平行堆积时垂直于层的相对位置;(c)是由(a)和(b)两种原子层交替堆积成
合金可看作由如图所示的(a)、(b)两种原子层交替堆积排列而成。图中虚线构建的六边形,表示由这两种层平行堆积时垂直于层的相对位置;(c)是由(a)和(b)两种原子层交替堆积成![]() 合金的晶体结构图。在这种结构中,同一层的
合金的晶体结构图。在这种结构中,同一层的![]() 距离为
距离为![]() 。
。

①![]() 合金中
合金中![]() __________。
__________。
②同一层中,![]() 原子之间的最短距离是__________
原子之间的最短距离是__________![]() ,设
,设![]() 为阿伏加德罗常数的值,若要求算
为阿伏加德罗常数的值,若要求算![]() 晶体的密度,还需要知道的物理量是_________(钙、铜元素的相对原子质量为已知量)。
晶体的密度,还需要知道的物理量是_________(钙、铜元素的相对原子质量为已知量)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】富马酸亚铁(C4H2O4Fe)是常用的治疗贫血的药物。可由富马酸与FeSO4反应制备。
(1)制备FeSO4溶液的实验步骤如下:
步骤1.称取4.0g碎铁屑,放入烧杯中,加入10%Na2CO3溶液,煮沸、水洗至中性。
步骤2.向清洗后的碎铁屑中加入3mol/L H2SO4溶液20mL,盖上表面皿,放在水浴中加热。不时向烧杯中滴加少量蒸馏水,控制溶液的pH不大于1。
步骤3.待反应速度明显减慢后,趁热过滤得FeSO4溶液。
①步骤1的实验目的是____。
②步骤2“不时向烧杯中滴加少量蒸馏水”的目的是____;“控制溶液的pH不大于1”的目的是____。
(2)制取富马酸亚铁的实验步骤及步骤(Ⅱ)的实验装置如下:
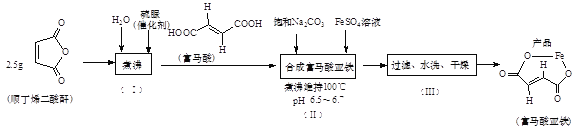
①步骤(Ⅰ)所得产品(富马酸)为_______-丁烯二酸(填“顺”或“反”)。
②富马酸与足量Na2CO3溶液反应的方程式为_________。
③图中仪器X的名称是_________,使用该仪器的目的是__________。
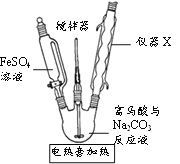
(3)测定(2)产品中铁的质量分数的步骤为:准确称取产品ag, 加入新煮沸过的3mol/LH2SO4溶液15mL,待样品完全溶解后,再加入新煮沸过的冷水50mL和4滴邻二氮菲-亚铁指示剂,立即用cmol/L (NH4)2Ce(SO4)3标准溶液滴定(Ce4++Fe2+=Ce3++Fe3+),滴定到终点时消耗标准液VmL。
①(NH4)2Ce(SO4)3标准溶液适宜盛放在_______(填“酸式”或“碱式”)滴定管中。
②该实验中能否用KMnO4标准溶液代替(NH4)2Ce(SO4)3标准溶液滴定Fe2+,说明理由_____。
③产品中铁的质量分数为________(用含a、V的代数式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】合成氨工业为人类解决粮食问题做出了巨大贡献.一定条件下,在密闭容器中进行合成氨反应:N2(g)+3H2(g)2NH3(g),当正、逆反应速率相等且不等于零时,下列说法不正确的是( )
A. N2、H2完全转化为NH3 B. N2、H2、NH3在容器中共存
C. 反应已达到化学平衡状态 D. N2、H2、NH3的浓度不再改变
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com