
【题目】下列说法正确的是
A. 燃料电池化学能100%转化为电能
B. 酶催化发生的反应,温度越高化学反应速率一定越快
C. 为减缓浸入海水中的钢铁水闸的腐蚀,可在其表面镶上铜锭
D. 向0.1mol/L氨水中加入少量水,溶液中![]() 增大
增大
 千里马走向假期期末仿真试卷寒假系列答案
千里马走向假期期末仿真试卷寒假系列答案科目:高中化学 来源: 题型:
【题目】已知:![]() +OH-
+OH-![]() NH3↑+H2O;有一混合物水溶液,可能含有以下离子中的若干种:K+、
NH3↑+H2O;有一混合物水溶液,可能含有以下离子中的若干种:K+、![]() 、Cl-、Mg2+、Fe3+、
、Cl-、Mg2+、Fe3+、![]() 、
、![]() ,现各取100mL溶液二份进行实验。
,现各取100mL溶液二份进行实验。
(1)向第一份加入足量NaOH溶液后加热,收集气体0.896L(标准状况);
(2)向第二份加入足量的BaCl2溶液,得到沉淀6.27g,沉淀经足量盐酸洗涤后,剩余2.33g。
试回答下列问题:(少填,错填都不得分)
(1)肯定存在的离子有___,肯定不存在的离子有___。
(2)试分别确定下列离子在原溶液中各自的物质的量浓度。
![]() :___;
:___;![]() :___;
:___;![]() :___。
:___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯化亚铜是一种重要的化工产品,广泛用于颜料、电镀和有机合成等方面。它不溶于H2SO4和醇,微溶于水,可溶于浓盐酸和氨水,在潮湿空气中易水解且被氧化成绿色的碱式氯化铜[Cu(OH)C1]。以海绵铜(主要成分是Cu,还含少量CuO)为原料,采用硝酸铵氧化分解技术生产CuCl的工艺流程如图:
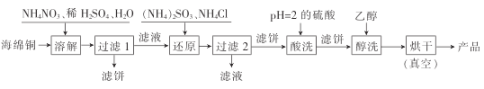
回答下列问题:
(1)为了提高“溶解”速率,工业生产中宜采用的措施有__(答两条即可)。
(2)写出“溶解”过程中发生氧化还原反应的离子方程式:__。
(3)“过滤2”所得滤液经蒸发浓缩、冷却结晶、过滤等操作获得一种化学肥料,它的主要成分是__(填化学式)。
(4)工业生产中,用pH=2的硫酸洗涤“产品”,其目的是__。
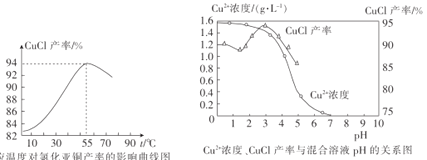
(5)氯化亚铜产率与温度、溶液pH的关系如图所示。据图分析,流程化生产氯化亚铜的过程中,温度过低会影响CuCl产率的原因是__;温度过高、pH过大也会影响CuCl产率的原因是__。
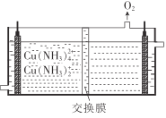
(6)目前利用膜电解再生氨性含铜蚀刻废液制备氯化亚铜的技术获得突破。首先在电解槽中电解氨性含铜蚀刻废液,电解后向阴极液中加入盐酸酸化,再倒入蒸馏水稀释得到氯化亚铜沉淀。电解装置如图所示,阴极区发生的电极反应为__,阳极区溶液的pH将__(填“变大”或“变小”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】最近罗格斯大学研究人员利用电催化技术高效率将CO2转化为X和Y(如下图), X、Y可用作制备塑料、粘合剂和药品的前体等。下列说法正确的是
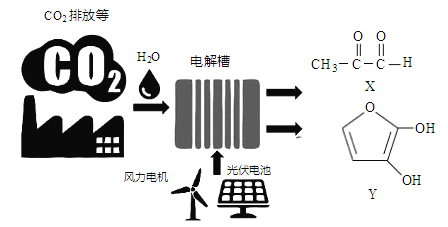
A. 图中能量转换方式只有2种
B. X、Y分子中所含的官能团相同
C. X、Y均是电解时的阳极产物
D. CO2资源化利用有利于解决大气中CO2浓度增加导致的环境问题
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,下列各组离子在指定溶液中能大量共存的是
A. 0.1mol/LFeCl3溶液:NH4+、K+、SCN-、NO3-
B. ![]() =0.1mol/L的溶液:K+、Cu2+、Br-、SO42-
=0.1mol/L的溶液:K+、Cu2+、Br-、SO42-
C. 能使甲基橙变红的溶液:Ca2+、NH4+、CH3COO-、Cl-
D. 由水电离产生的c(H+)=1×10-13mol/L的溶液:Na+、K+、Cl-、NO3-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲醇是一种可再生能源,具有广阔的开发和应用前景,可用![]() 等作为催化剂,采用如下反应来合成甲醇:
等作为催化剂,采用如下反应来合成甲醇:![]()
(1)下表是有关化学键的键能数据,计算表中的a=__________。
化学键 |
|
|
|
|
|
键能 | 436 | 462.8 | a | 1075 | 351 |
(2)将![]() 的混合气体,匀速通过装有催化剂的反应器反应(如图甲),反应器温度变化与从反应器排出气体中
的混合气体,匀速通过装有催化剂的反应器反应(如图甲),反应器温度变化与从反应器排出气体中![]() 的体积分数φ关系如图乙,φ(CH3OH)变化的原因是__________。
的体积分数φ关系如图乙,φ(CH3OH)变化的原因是__________。
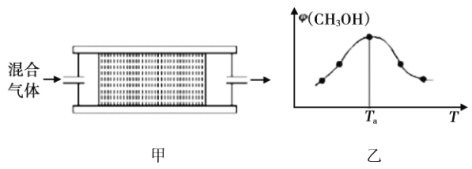
(3)某学习小组模拟工业合成甲醇的反应,在![]() 的恒容密闭容器内充入
的恒容密闭容器内充入![]() 和
和![]() ,加入合适催化剂后在某温度下开始反应,并用压力计监测容器内压强的变化如表:
,加入合适催化剂后在某温度下开始反应,并用压力计监测容器内压强的变化如表:
反应时间/min | 0 | 5 | 10 | 15 | 20 | 25 |
压强/MPa | 12.6 | 10.8 | 9.5 | 8.7 | 8.4 | 8.4 |
从反应开始到![]() 时,
时,![]() 的平均反应速率为______,该温度下的平衡常数
的平均反应速率为______,该温度下的平衡常数![]() 为______。
为______。
(4)另将![]() 和
和![]() 加入密闭容器中,在一定条件下发生上述反应。平衡时
加入密闭容器中,在一定条件下发生上述反应。平衡时![]() 的体积分数(%)与温度和压强的关系如图所示(虚线框表示没有测定该条件下的数据)。
的体积分数(%)与温度和压强的关系如图所示(虚线框表示没有测定该条件下的数据)。
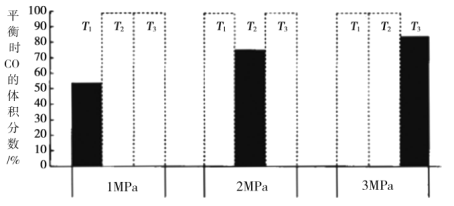
![]() 由大到小的关系是__________,判断理由是__________。
由大到小的关系是__________,判断理由是__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在两个容积均为2L恒温密闭容器中,起始时均充入amolH2S,控制不同温度和分别在有、无Al2O3催化时进行H2S的分解实验[反应为:2H2S(g)![]() 2H2(g)+S2(g)]。测得的结果如下图所示(曲线Ⅱ、Ⅲ表示经过相同时间且未达到化学平衡时H2S的转化率)。
2H2(g)+S2(g)]。测得的结果如下图所示(曲线Ⅱ、Ⅲ表示经过相同时间且未达到化学平衡时H2S的转化率)。
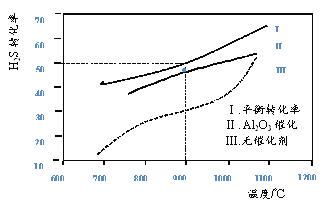
下列说法不正确的是
A. H2S分解为放热反应
B. 加入Al2O3 可提高H2S的平衡转化率
C. 900℃反应2H2S(g)![]() 2H2(g)+S2(g)的平衡常数K=0.125a
2H2(g)+S2(g)的平衡常数K=0.125a
D. 约1100℃曲线Ⅱ、Ⅲ几乎重合,说明Al2O3可能几乎失去催化活性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列根据实验操作和现象所得出的结论正确的是
选项 | 实验操作 | 实验现象 | 结论 |
A | 将SO2气体通入Ba(NO3)2溶液 | 有白色沉淀 | SO2中混有SO3 |
B | 向NaAlO2溶液中持续通入气体Y | 先出现白色沉淀,最终沉淀又溶解 | Y可能是CO2气体 |
C | AgCl悬浊液中滴入少量Na2S溶液 | 沉淀变黑色 | Ksp(Ag2S)>Ksp(AgCl) |
D | 向盛有KI3溶液的两试管中分别加入淀粉溶液和AgNO3溶液 | 前者溶液变蓝色,后者有黄色沉淀 | KI3溶液中存在平衡: I3- |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列解释事实的离子方程式中,不正确的是( )
A.向FeCl2溶液中通入氯气,溶液变为黄色:2Fe2++ Cl2= 2Fe3++ 2Cl-
B.向铜粉中滴加稀硝酸,产生气体:Cu + 4H++ 2NO![]() =Cu2++ 2NO2↑+ 2H2O
=Cu2++ 2NO2↑+ 2H2O
C.向CuSO4溶液中滴加NaOH溶液,产生蓝色沉淀:Cu2++ 2OH-=Cu(OH)2↓
D.自来水中通入Cl2可以杀菌消毒:Cl2+H2O![]() H++Cl-+HClO
H++Cl-+HClO
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com