
【题目】在两个容积均为2L恒温密闭容器中,起始时均充入amolH2S,控制不同温度和分别在有、无Al2O3催化时进行H2S的分解实验[反应为:2H2S(g)![]() 2H2(g)+S2(g)]。测得的结果如下图所示(曲线Ⅱ、Ⅲ表示经过相同时间且未达到化学平衡时H2S的转化率)。
2H2(g)+S2(g)]。测得的结果如下图所示(曲线Ⅱ、Ⅲ表示经过相同时间且未达到化学平衡时H2S的转化率)。
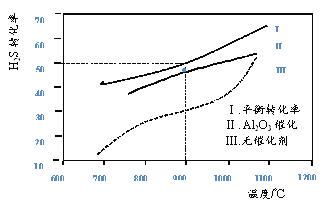
下列说法不正确的是
A. H2S分解为放热反应
B. 加入Al2O3 可提高H2S的平衡转化率
C. 900℃反应2H2S(g)![]() 2H2(g)+S2(g)的平衡常数K=0.125a
2H2(g)+S2(g)的平衡常数K=0.125a
D. 约1100℃曲线Ⅱ、Ⅲ几乎重合,说明Al2O3可能几乎失去催化活性
科目:高中化学 来源: 题型:
【题目】“空气吹出法”海水提溴的工艺流程如图:

下列说法错误的是( )
A.进入吹出塔前,Br-被氧化为Br2
B.从吹出塔进入吸收塔的物质为混合物
C.蒸馏塔中只发生了物理变化
D.经过吸收塔后,溴元素得到富集
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设![]() 为阿伏加德罗常数的值。化工厂常用浓氨水来检验氯气管道是否发生泄漏,其原理是:
为阿伏加德罗常数的值。化工厂常用浓氨水来检验氯气管道是否发生泄漏,其原理是:![]() 。下列说法正确的是( )
。下列说法正确的是( )
A.如果氯气管道漏气,则会看到有大量白雾生成
B.反应中每形成![]() 键,转移电子数为
键,转移电子数为![]()
C.![]() 的
的![]() 溶液中,
溶液中,![]() 的数目小于
的数目小于![]()
D.该反应中,氧化剂与还原剂的物质的量之比为![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. 燃料电池化学能100%转化为电能
B. 酶催化发生的反应,温度越高化学反应速率一定越快
C. 为减缓浸入海水中的钢铁水闸的腐蚀,可在其表面镶上铜锭
D. 向0.1mol/L氨水中加入少量水,溶液中![]() 增大
增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁、铜及其化合物应用广泛。回答下列问题:
(1)基态铁原子核外最后一个电子填充在__________(填能级符号),含有__________个成单电子,具有磁性。
(2)铁氰化钾![]() 是检验
是检验![]() 的重要试剂。
的重要试剂。
①铁氰化钾中,所涉及的元素的第一电离能由大到小的顺序为__________。
②铁氰化钾中,不存在__________(填字母标号)。
A.离子键 B.σ键 C.π键 D.氢键 E.金属键
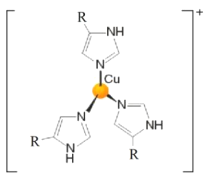
(3)血蓝蛋白是某些节肢动物体内能与氧气可逆结合的一种铜蛋白,其部分结构示意图如图。其中![]() 的化合价为_______价,
的化合价为_______价,![]() 的杂化类型是__________。
的杂化类型是__________。
(4)![]() 合金可看作由如图所示的(a)、(b)两种原子层交替堆积排列而成。图中虚线构建的六边形,表示由这两种层平行堆积时垂直于层的相对位置;(c)是由(a)和(b)两种原子层交替堆积成
合金可看作由如图所示的(a)、(b)两种原子层交替堆积排列而成。图中虚线构建的六边形,表示由这两种层平行堆积时垂直于层的相对位置;(c)是由(a)和(b)两种原子层交替堆积成![]() 合金的晶体结构图。在这种结构中,同一层的
合金的晶体结构图。在这种结构中,同一层的![]() 距离为
距离为![]() 。
。

①![]() 合金中
合金中![]() __________。
__________。
②同一层中,![]() 原子之间的最短距离是__________
原子之间的最短距离是__________![]() ,设
,设![]() 为阿伏加德罗常数的值,若要求算
为阿伏加德罗常数的值,若要求算![]() 晶体的密度,还需要知道的物理量是_________(钙、铜元素的相对原子质量为已知量)。
晶体的密度,还需要知道的物理量是_________(钙、铜元素的相对原子质量为已知量)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Na2S可用于制造硫化染料、沉淀水体中的重金属等。
(1)Na2S溶液中S2-水解的离子方程式为_________。
(2)室温时,几种重金属离子的硫化物的溶度积常数如下表:
金属硫化物 | FeS | PbS | CuS | HgS |
Ksp | 6.3×10-18 | 1.0×10-28 | 6.3×10-36 | 1.6×10-52 |
①向物质的量浓度相同的Fe2+、Pb2+、Cu2+、Hg2+的混合稀溶液中,逐滴加入Na2S稀溶液,首先沉淀的离子是____。
②用Na2S溶液沉淀废水中Pb2+,为使Pb2+沉淀完全[c(Pb2+)≤1×10-6mol/L],则应满足溶液中c(S2-)≥_____mol/L。
③反应Cu2+(aq)+FeS(s)![]() Fe2+(aq)+CuS(s)的平衡常数K=_______。
Fe2+(aq)+CuS(s)的平衡常数K=_______。
(3)测定某Na2S和NaHS混合样品中两者含量的实验步骤如下:
步骤1.准确称取一定量样品于烧杯中,加入少量蒸馏水溶解,转移至500mL容量瓶中定容。
步骤2.准确移取25.00mL上述溶液于锥形瓶中,加入茜素黄GG-百时香酚蓝混合指示剂,用0.2500mol/L盐酸标准溶液滴定(Na2S+HCl=NaHS+NaCl)至终点,消耗盐酸24.00mL;向其中再加入5mL中性甲醛(NaHS+HCHO+H2O→NaOH+HSCH2OH)和3滴酚酞指示剂,继续用0.2500mol/L盐酸标准溶液滴定(NaOH+HCl=NaCl+H2O)至终点,又消耗盐酸34.00mL。
计算原混合物中Na2S与NaHS的物质的量之比(写出计算过程)___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】富马酸亚铁(C4H2O4Fe)是常用的治疗贫血的药物。可由富马酸与FeSO4反应制备。
(1)制备FeSO4溶液的实验步骤如下:
步骤1.称取4.0g碎铁屑,放入烧杯中,加入10%Na2CO3溶液,煮沸、水洗至中性。
步骤2.向清洗后的碎铁屑中加入3mol/L H2SO4溶液20mL,盖上表面皿,放在水浴中加热。不时向烧杯中滴加少量蒸馏水,控制溶液的pH不大于1。
步骤3.待反应速度明显减慢后,趁热过滤得FeSO4溶液。
①步骤1的实验目的是____。
②步骤2“不时向烧杯中滴加少量蒸馏水”的目的是____;“控制溶液的pH不大于1”的目的是____。
(2)制取富马酸亚铁的实验步骤及步骤(Ⅱ)的实验装置如下:
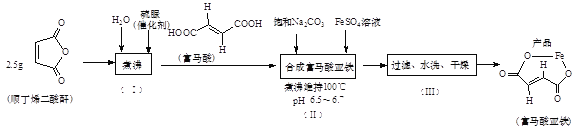
①步骤(Ⅰ)所得产品(富马酸)为_______-丁烯二酸(填“顺”或“反”)。
②富马酸与足量Na2CO3溶液反应的方程式为_________。
③图中仪器X的名称是_________,使用该仪器的目的是__________。
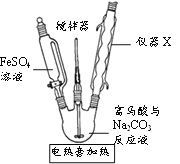
(3)测定(2)产品中铁的质量分数的步骤为:准确称取产品ag, 加入新煮沸过的3mol/LH2SO4溶液15mL,待样品完全溶解后,再加入新煮沸过的冷水50mL和4滴邻二氮菲-亚铁指示剂,立即用cmol/L (NH4)2Ce(SO4)3标准溶液滴定(Ce4++Fe2+=Ce3++Fe3+),滴定到终点时消耗标准液VmL。
①(NH4)2Ce(SO4)3标准溶液适宜盛放在_______(填“酸式”或“碱式”)滴定管中。
②该实验中能否用KMnO4标准溶液代替(NH4)2Ce(SO4)3标准溶液滴定Fe2+,说明理由_____。
③产品中铁的质量分数为________(用含a、V的代数式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物![]() (x)
(x)![]() (y)
(y)![]() (z)的分子式均为C8H8,下列说法正确的是
(z)的分子式均为C8H8,下列说法正确的是
A. x、y、z均能使Br2的CCl4溶液褪色
B. x的同分异构体只有y和z
C. x、y、z的二氯代物均只有三种
D. x、y、z中只有y中所有原子可以处于同一平面
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有反应:①NaOH+HCl=NaCl+H2O, ②Fe+H2SO4=FeSO4+H2↑。
回答下列问题:
(1)两反应中属于氧化还原反应的是_____(填序号,下同),能设计成原电池的是___。
(2)Fe—Cu原电池的装置如图所示。
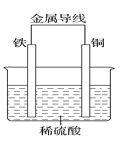
①铁作_____(填“正极”或“负极”),溶液中H+向____(填“铁”或“铜”)电极方向移动。
②正极的现象是________,负极的电极反应式为________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com