
【题目】现有反应:①NaOH+HCl=NaCl+H2O, ②Fe+H2SO4=FeSO4+H2↑。
回答下列问题:
(1)两反应中属于氧化还原反应的是_____(填序号,下同),能设计成原电池的是___。
(2)Fe—Cu原电池的装置如图所示。
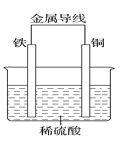
①铁作_____(填“正极”或“负极”),溶液中H+向____(填“铁”或“铜”)电极方向移动。
②正极的现象是________,负极的电极反应式为________。
科目:高中化学 来源: 题型:
【题目】在两个容积均为2L恒温密闭容器中,起始时均充入amolH2S,控制不同温度和分别在有、无Al2O3催化时进行H2S的分解实验[反应为:2H2S(g)![]() 2H2(g)+S2(g)]。测得的结果如下图所示(曲线Ⅱ、Ⅲ表示经过相同时间且未达到化学平衡时H2S的转化率)。
2H2(g)+S2(g)]。测得的结果如下图所示(曲线Ⅱ、Ⅲ表示经过相同时间且未达到化学平衡时H2S的转化率)。
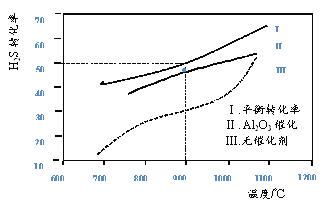
下列说法不正确的是
A. H2S分解为放热反应
B. 加入Al2O3 可提高H2S的平衡转化率
C. 900℃反应2H2S(g)![]() 2H2(g)+S2(g)的平衡常数K=0.125a
2H2(g)+S2(g)的平衡常数K=0.125a
D. 约1100℃曲线Ⅱ、Ⅲ几乎重合,说明Al2O3可能几乎失去催化活性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物Q是有机合成的重要中间体,制备Q的一种合成路线如下(部分反应条件和试剂略去)。
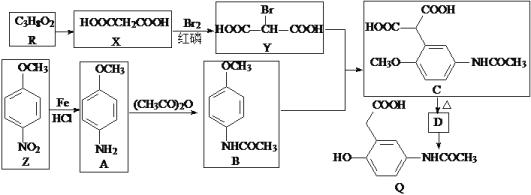
回答下列问题:
(1)Y中不含氧的官能团名称为__________,R的名称为_________________________。
(2)加热C脱去CO2生成D,D的结构简式为____________________________。
(3)B+Y→C的反应类型是_______________,Q的分子式为____________________。
(4)A→B的化学方程式为______________________________________________。
(5)同时满足下列条件的Z的同分异构体有_____________种(不包括立体异构)。①能与氯化铁溶液发生显色反应;②能与碳酸氢钠反应;③含―NH2; ④苯环上有处于对位的取代基
(6)已知:―NH2具有强还原性。参照上述合成路线,以![]() 为原料(无 机试剂任选),设计制备
为原料(无 机试剂任选),设计制备![]() 的合成路线:__________。(格式:CH2=CH2
的合成路线:__________。(格式:CH2=CH2![]() CH3CH2Br
CH3CH2Br![]() CH3CH2OH)
CH3CH2OH)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列解释事实的离子方程式中,不正确的是( )
A.向FeCl2溶液中通入氯气,溶液变为黄色:2Fe2++ Cl2= 2Fe3++ 2Cl-
B.向铜粉中滴加稀硝酸,产生气体:Cu + 4H++ 2NO![]() =Cu2++ 2NO2↑+ 2H2O
=Cu2++ 2NO2↑+ 2H2O
C.向CuSO4溶液中滴加NaOH溶液,产生蓝色沉淀:Cu2++ 2OH-=Cu(OH)2↓
D.自来水中通入Cl2可以杀菌消毒:Cl2+H2O![]() H++Cl-+HClO
H++Cl-+HClO
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,在2 L密闭容器中发生反应:A(g)+3B(g) === 2C(g) + 4D(g),测得5 min内,A的物质的量减小了10 mol,则5 min内该反应的化学反应速率是
A. υ(A) = 1 mol/(L·min)
B. υ(B) = 1 mol/(L·min)
C. υ(C) = 1 mol/(L·min)
D. υ(D) = 1 mol/(L·min)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Fenton法常用于处理含难降解有机物的工业废水,通常是在调节好pH和Fe2+浓度的废水中加入H2O2,所产生的羟基自由基能氧化降解污染物,羟基自由基的产生与溶液pH大小有关。现运用该方法降解有机污染物p-CP,探究有关因素对该降解反应速率的影响。
(实验过程)

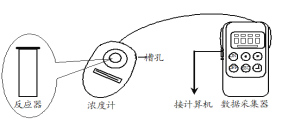
用图所示装置进行如下表所示的实验,控制p-CP的初始浓度相同,其余实验条件见下表,设计如下对比实验,最终测量的是p-CP浓度的改变量。
(实验数据)
实验编号 | H2O2溶液 | Fe2+溶液 | 蒸馏水 | pH | 温度 | ||
c/(10-3mol·L-1) | V/mL | c/(10-3mol·L-1) | V/mL | V/mL | T/K | ||
① | 6.0 | 1.5 | 0.30 | 3.5 | 10 | 3 | 298 |
② | 6.0 | 1.5 | 0.30 | 3.5 | 10 | 3 | 313 |
③ | 6.0 | 3.5 | 0.30 | 3.5 | x | 3 | 298 |
④ | 6.0 | 1.5 | 0.30 | 4.5 | 9 | 3 | 298 |
⑤ | 6.0 | 1.5 | 0.30 | 3.5 | 10 | 10 | 298 |
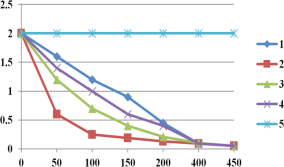
图2实验测得p-CP的浓度随时间的变化
(分析与解释)
(1)实验③中,x=________。
(2)实验①、⑤的目的是________。
(3)实验①、②表明温度升高,降解反应速率增大。但温度过高是反而导致降解反应速率减少,从Fenton法所用试剂H2O2性质的角度分析原因_____(请用化学用语解答)。
(4)通过实验⑤可以得出结论是是pH等于10时,降解反应趋于停止,推测可能的原因:__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是在载人航天器舱内利用氢氧燃料电池进行二氧化碳浓缩富集的装置。下列说法正确的是
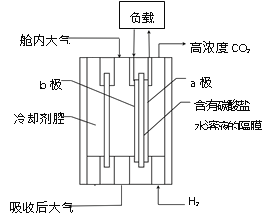
A. a极为电池的正极
B. b极的电极反应:2CO2 + O2 + 4e- === 2CO32-
C. 该装置工作时电能转化成了化学能
D. CO32- 向b极移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】科研人员研究了通电条件下N2在催化剂Au(金)表面生成NH3的反应,反应机理如图所示,下列说法不正确的是
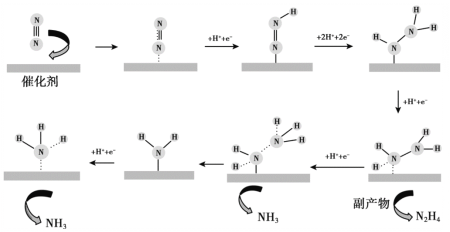
A.上述转化过程中涉及非极性键的断裂和极性键的生成
B.生成NH3的总电极反应式为:N2 + 6H+ + 6e- = 2NH3
C.当1 mol N2在电解池的阴极发生反应时,可得到2 mol NH3
D.使用Au作催化剂可以降低反应的活化能,从而提高化学反应速率
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com