
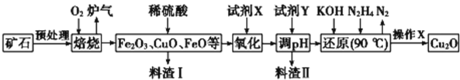
【题目】氧化亚铜(Cu2O)是一种用途广泛的光电材料,某工厂以硫化铜矿石(含 CuFeS2、Cu2S等)为原料制取Cu2O的工艺流程如下:
常温下几种物质开始形成沉淀与完全沉淀时的pH如下表:
Fe(OH)2 | Fe(OH)3 | Cu(OH)2 | |
开始沉淀 | 7.5 | 2.7 | 4.8 |
完全沉淀 | 9.0 | 3.7 | 6.4 |
(1)炉气中的有害气体成分是________,Cu2S与O2反应时,氧化剂与还原剂的物质的量之比为______。
(2)试剂X是H2O2溶液,当试剂X是___________时,更有利于降低生产成本。
(3)加入试剂Y调pH时,pH的调控范围是________。
(4)“还原”步骤中为提高N2H4转化率可采取的措施有_________(填序号)。
a.不断搅拌,使N2H4和溶液充分接触 b.增大通入N2H4的流速
c.减少KOH的进入量 d.减小通入N2H4的流速
(5)写出用N2H4制备Cu2O的化学方程式为_______________
(6)操作X包括烘干,其中烘干时要隔绝空气,其目的是____________。
【答案】SO2 2∶1 空气或氧气 3.7≤pH<4.8 ad 4CuSO4+N2H4+8KOH![]() 2Cu2O+N2↑+4K2SO4+6H2O 防止Cu2O被空气中氧气氧化
2Cu2O+N2↑+4K2SO4+6H2O 防止Cu2O被空气中氧气氧化
【解析】
根据流程:硫化铜矿石(含CuFeS2、Cu2S等)预处理后与氧气焙烧,根据后续流程可知该过程中Cu元素全部转化为CuO,铁元素转化为FeO和Fe2O3,根据S元素的价态规律可知其转化为SO2;加入稀硫酸溶解金属氧化物,得到含有Cu2+、Fe2+、Fe3+的酸性溶液,加入试剂X将Fe2+氧化为Fe3+,加入试剂Y调节pH为3.7~4.8沉淀Fe3+,过滤,将滤液用KOH、N2H4还原,得到氧化亚铜沉淀,过滤,洗涤、隔绝空气烘干,制得Cu2O,据此分析作答。
(1)焙烧过程中S元素会被氧化成有害气体SO2;Cu2S与O2反应时Cu元素化合价由+1价升为+2价,S元素化合价由-2价升为+4价,所以Cu2S为还原剂,整体化合价升高8价,O2为氧化剂,O元素由0价降为-2价,一个氧气降低4价,所以氧化剂和还原剂的物质的量之比为2:1;
(2)酸性条件下,氧气也可将Fe2+氧化为Fe3+,而氧气或空气价格远低于过氧化氢,故可用氧气或空气替代过氧化氢,降低成本;
(3)加入试剂Y的目的是调节pH完全沉淀Fe3+,但不沉淀Cu2+,根据表中数据可知,pH范围为:3.7≤pH<4.8;
(4)a.不断搅拌,使N2H4和溶液充分接触可以加快反应速率,提高单位时间内N2H4的转化率,故a符合题意;
b.流速过快N2H4不能充分反应,转化率减小,故b不符合题意;
c.减少KOH的进入量会降低溶液对N2H4的吸收量,转化率减小,故c不符合题意;
d.减小通入N2H4的流速可以使反应更充分,故d符合题意;
综上所述选ad;
(5)N2H4制备Cu2O的反应物有CuSO4、N2H4和KOH,产物有N2和Cu2O等,该过程中+2价的铜元素将-2价的N元素氧化,根据电子守恒和元素守恒可得化学方程式为4CuSO4+N2H4+8KOH![]() 2Cu2O+N2↑+4K2SO4+6H2O;
2Cu2O+N2↑+4K2SO4+6H2O;
(6)因为Cu2O具有还原性,在加热条件下易被空气氧化,故烘干过程要隔绝空气;


科目:高中化学 来源: 题型:
【题目】俗名为“臭碱”的硫化钠广泛应用于冶金染料、皮革、电镀等工业。硫化钠的一种制备方法是Na2SO4+2C![]() Na2S+2CO2↑。下列有关说法正确的是( )(设NA表示阿伏加德罗常数的值)
Na2S+2CO2↑。下列有关说法正确的是( )(设NA表示阿伏加德罗常数的值)
A.Na2SO4和Na2S均为离子晶体,晶体中每个SO![]() 或S2-周围均有2个Na+
或S2-周围均有2个Na+
B.C(金刚石)属于共价晶体,1mol该晶体中含的σ键数目为4NA
C.生成1mol氧化产物时转移电子数为4NA
D.标准状况下22.4LCO2中含π键的数目为NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学在做原电池原理的实验时,有如下实验步骤:
①用导线将灵敏电流计的两端分别与纯净的锌片和铜片相连接(如图1);
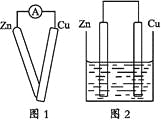
②把一块纯净的锌片插入盛有稀硫酸的烧杯中;
③把一块纯净的铜片插入盛有稀硫酸的烧杯中;
④用导线把锌片和铜片连接起来后,再平行地插入盛有稀硫酸的烧杯中(如图2)。
回答下列问题:
(1)实验步骤①中应观察到的现象是_______________________。
(2)实验步骤②中应观察到的现象是_______________________。
(3)实验步骤③中应观察到的现象是_______________________。
(4)实验步骤④中应观察到的现象是_______________________。
(5)通过实验步骤④该同学头脑中有了一个猜想(或假设),该猜想是_______。
(6)为了证实该猜想,该同学又设计了第⑤步实验,请简要画出第⑤步实验的装置示意图。______
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组离子在溶液中可以大量共存,且加入或通入试剂X后,发生反应的离子方程式正确的是
选项 | 离子组 | 试剂X | 发生反应的离子方程式 |
A | K+、Na+、 | 少量HCl | H2O+H++ |
B |
| 少量H2S | Fe2++H2S=FeS↓+2H+ |
C | ClO-、Na+、Ca2+、 | 少量CO2 | CO2+Ca2++H2O+2ClO-=CaCO3↓+2HClO |
D | I-、Cl-、Na+、 | 少量稀硝酸 | 6I-+2 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表列出了9种元素在元素周期表中的位置示意。
周期 | ⅠA 1 | 0 18 | ||||||
1 | ⅡA 2 | ⅢA 13 | ⅣA 14 | ⅤA 15 | ⅥA 16 | ⅦA 17 | ||
2 | ① | ② | ③ | ④ | ⑤ | |||
3 | ⑥ | ⑦ | ⑧ | |||||
4 | ⑨ | |||||||
请回答下列问题:
(1)考古工作者利用元素②的一种核素测定一些文物的年代,这种核素的符号是_____
(2)画出元素⑧形成的简单离子的结构示意图_________________
(3)写出元素④和⑥的单质在加热条件下反应,所得产物的电子式为_________
(4)⑥元素的最高价氧化物对应的水化物含有的化学键是__________________
(5)②、③、④、⑤四种元素的简单气态氢化物中,稳定性最强的是_______(填化学式),写出元素⑥的单质与水反应的离子反应方程式___________________,写出一个能证明元素⑧比元素⑨非金属性强的反应事实的离子方程式__________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,10mL0.40mol·L-1过氧化氢溶液发生催化分解。不同时刻测得生成氧气的体积(已折算为标准状况)如下表。
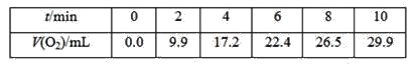
下列叙述不正确的是(溶液体积变化忽略不计)( )
A.0~6min的平均反应速率:v(H2O2)≈3.3×10-2mol·L-1·min-1
B.6~10min的平均反应速率:v(H2O2)<3.3×10-2mol·L-1·min-1
C.反应到6min时,c(H2O2)=0.30mol·L-1
D.反应到6min时,过氧化氢分解了50%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究小组同学为探究锌与硫酸反应生成SO2、H2的临界浓度(浓硫酸能与锌反应生成SO2的最低浓度)设计了如下实验。在大试管A中加入100mL 18mol/L硫酸,向连接在塑料棒上的多孔塑料球内加入足量的锌粒(塑料棒可以上下移动),在试剂瓶D中加入足量的浓NaOH溶液(加热和夹持装置已省略)。
已知:锌与浓硫酸接触,开始时反应缓慢,可以适当加热以加速其反应,当有大量气泡生成时,该反应速率会明显加快并伴有大量的热放出。
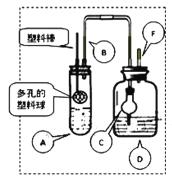
(1)请写出锌与硫酸反应产生SO2的化学方程式_______。
(2)在组装仪器之后,加入试剂之前必须进行的操作是__________。
(3)长导管B的作用是______,如果没有这个设计,最终测定的临界浓度会_______。(填“偏高”、“偏低”或“无影响”)
(4)装置中干燥管C的作用是_______。
(5)反应结束后向D装置中加入足量的H2O2溶液和足量的BaCl2溶液,充分反应后将所得沉淀过滤、洗涤、干燥、称量得到固体质量为a克,则浓硫酸与锌反应的临界浓度为:_________mol/L。(用含a的计算式表示,忽略体积变化)
(6)某同学通过联系氧化还原反应的相关知识,认为也可以利用硫酸酸化的高锰酸钾溶液对D中的SO![]() 进行滴定,通过滴定出的SO
进行滴定,通过滴定出的SO![]() 的物质的量计算临界浓度,你认为他的这一想法是否可行?______(填“可行”或“不可行”),原因是_____。
的物质的量计算临界浓度,你认为他的这一想法是否可行?______(填“可行”或“不可行”),原因是_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲、乙、丙三种物质是合成聚酯玻璃钢的基本原料,下列说法中错误的是( )
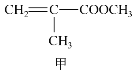
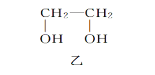
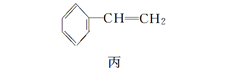
A.1mol乙可与2mol钠完全反应生成1mol氢气
B.三种物质中只有甲和丙能够使酸性高锰酸钾溶液褪色
C.甲和丙在一定条件下发生相同类型的反应
D.乙能与乙二酸反应成环
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关图像,其中说法正确的是

A. 由图Ⅰ知,反应在 T1、T3 处达到平衡
B. 由图Ⅰ知,该反应的△H<0
C. 由图Ⅱ知,t3时采取降低反应温度的措施
D. 由图Ⅱ知,反应在 t6时,NH3 体积分数最大
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com