
【题目】甲、乙、丙三种物质是合成聚酯玻璃钢的基本原料,下列说法中错误的是( )
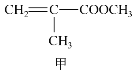
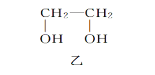
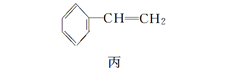
A.1mol乙可与2mol钠完全反应生成1mol氢气
B.三种物质中只有甲和丙能够使酸性高锰酸钾溶液褪色
C.甲和丙在一定条件下发生相同类型的反应
D.乙能与乙二酸反应成环
 每课必练系列答案
每课必练系列答案科目:高中化学 来源: 题型:
【题目】雾霾中含有许多颗粒物,炭黑是其中一种,研究发现它可以活化氧分子,生成活化氧。活化过程的能量变化模拟计算结果如图所示。活化氧可以快速氧化SO2。下列说法正确的是( )
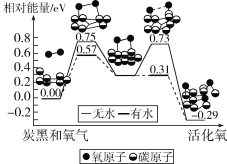
A.每活化一个氧分子吸收0.29eV能量
B.水可使氧分子活化反应的活化能降低0.18eV
C.氧分子的活化是O—O键的断裂与C—O键的生成过程
D.炭黑颗粒是大气中SO2转化为SO3的氧化剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氧化亚铜(Cu2O)是一种用途广泛的光电材料,某工厂以硫化铜矿石(含 CuFeS2、Cu2S等)为原料制取Cu2O的工艺流程如下:
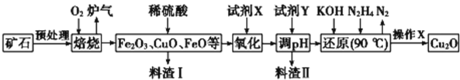
常温下几种物质开始形成沉淀与完全沉淀时的pH如下表:
Fe(OH)2 | Fe(OH)3 | Cu(OH)2 | |
开始沉淀 | 7.5 | 2.7 | 4.8 |
完全沉淀 | 9.0 | 3.7 | 6.4 |
(1)炉气中的有害气体成分是________,Cu2S与O2反应时,氧化剂与还原剂的物质的量之比为______。
(2)试剂X是H2O2溶液,当试剂X是___________时,更有利于降低生产成本。
(3)加入试剂Y调pH时,pH的调控范围是________。
(4)“还原”步骤中为提高N2H4转化率可采取的措施有_________(填序号)。
a.不断搅拌,使N2H4和溶液充分接触 b.增大通入N2H4的流速
c.减少KOH的进入量 d.减小通入N2H4的流速
(5)写出用N2H4制备Cu2O的化学方程式为_______________
(6)操作X包括烘干,其中烘干时要隔绝空气,其目的是____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海洋植物如海带、海藻中含有丰富的碘元素,主要以碘化物形式存在。有一化学课外小组用海带为原料制取少量碘单质,他们将海带灼烧成灰,用水浸泡一段时间(碘化物充分溶解在水中),得到海带灰悬浊液,然后按以下实验流程提取单质碘:(已知:2I-+Cl2=2Cl-+I2)
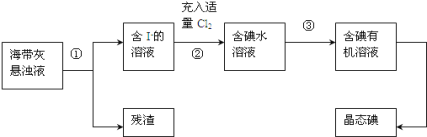
(1)指出提取碘的过程中有关的实验操作名称:①______,③ _____。
(2)过程②中充入适量Cl2的目的是(用方程式解释)_________________,把溶液中的I-转化成I2。
(3)操作③中所用的有机试剂可以是______________(只填一种)。
(4)操作过程③可以分解为如下几步:
A.把盛有溶液的分液漏斗放在铁架台的铁圈中;
B.把50mL碘水和15mL有机溶剂加入分液漏斗中,并盖好玻璃塞;
C.检验分液漏斗活塞和上口的玻璃塞是否漏液;
D.倒转漏斗用力振荡,并不时旋开活塞放气,最后关闭活塞,把分液漏斗放正;
E.旋开活塞,用烧杯接收溶液;
F.从分液漏斗上口倒出上层液体;
G.将漏斗上口的玻璃塞打开或使塞上的凹槽与漏斗上口的小孔对准;
H.静置、分层。
过程③正确操作步骤的顺序是:(填编号字母)_______→________→________→A→H→________→E→F。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铜与锌用导线连接后,插入稀硫酸中形成原电池。
(1)分析图并填空:__。
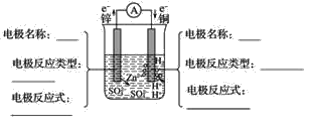
(2)原电池总反应式(离子方程式)__。
(3)上述装置产生电流的原因是__。
(4)上述装置的能量转化是__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学用语是学习化学的重要工具,下列用来表示物质变化的化学用语中,正确的是( )
A.铜作电极材料电解饱和食盐水时总反应为:2H2O+2Cl-![]() Cl2↑+H2↑+2OH-
Cl2↑+H2↑+2OH-
B.铅蓄电池充电时阳极反应式为:PbSO4-2e-+2H2O=PbO2+4H++SO42-
C.粗铜精炼时,与电源正极相连的是纯铜,电极反应式为:Cu-2e-=Cu2+
D.钢铁发生电化学腐蚀的正极反应式:Fe-3e-=Fe3+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】绿色化学,体现了人类可持续发展的客观要求。尿素电氧化法在碱性条件下将工业废水和生活污水富含的尿素转化为对环境无害的物质,并将化学能转化电能(图1),由尿素电氧化法产生的电能可供治理硫化氢(图2)。
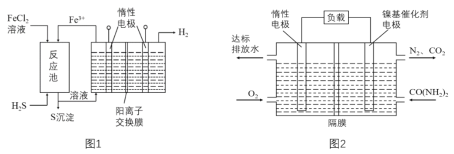
(1)写出CO(NH2)2的电子式:___。
(2)尿素电氧化法负极发生的反应为:___,隔膜为___(填“阴”或“阳”)离子交换膜。
(3)先用FeCl3溶液吸收含H2S的工业废气,所得溶液用惰性电极电解,阳极区所得溶液循环利用,见图1。
①处理掉废水中尿素,消耗22.4L O2(标准状况下)时,可供治理硫化氢,产生___gS沉淀;电解池的溶液中,溶质是___。
②阳极的电极反应式为___。
③电解总反应的离子方程式是___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:8NH3(g) +6NO2(g) ![]() 7N2(g) +12H2O(1) △H<0。相同条件下,向2 L恒容密闭容器内充入一定量的NH3和NO2,分别选用不同的催化剂进行已知反应(不考虑NO2和N2O4之间的相互转化),反应生成N2的物质的量随时间的变化如图所示。下列说法错误的是( )
7N2(g) +12H2O(1) △H<0。相同条件下,向2 L恒容密闭容器内充入一定量的NH3和NO2,分别选用不同的催化剂进行已知反应(不考虑NO2和N2O4之间的相互转化),反应生成N2的物质的量随时间的变化如图所示。下列说法错误的是( )
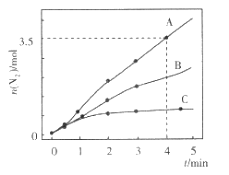
A.在催化剂A的作用下,0 ~4 min 内v(NH3)=1.0mol![]() L-1
L-1![]() min-1
min-1
B.若在恒容绝热的密闭容器中反应,当容器内温度不变时,说明反应已经达到平衡
C.不同催化剂作用下,该反应的活化能由大到小的顺序是Ea(C)> Ea(B)> Ea(A)
D.升高温度可使容器内气体颜色变浅
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铜是人类发现最早并广泛使用的一种金属。溶液中Cu2+的浓度可采用碘量法测得:
①2Cu2++5I-=2CuI↓+![]()
②![]() +2
+2![]() =
=![]() +3I-
+3I-
现取某20.00mL含Cu2+的溶液。加入足量的KI充分反应后,用0.1000mo1·L-1的Na2S2O3标准溶液滴定至终点,消耗Na2S2O3溶液体积如表所示。
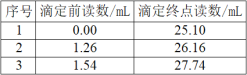
(1)溶液中Cu2+的浓度为___mol·L-1。
(2)用移液管量取20.00mLCu2+的溶液时俯视刻度线,最终测得的Cu2+的浓度将___(“偏高、偏低或无影响”)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com