
【题目】化学用语是学习化学的重要工具,下列用来表示物质变化的化学用语中,正确的是( )
A.铜作电极材料电解饱和食盐水时总反应为:2H2O+2Cl-![]() Cl2↑+H2↑+2OH-
Cl2↑+H2↑+2OH-
B.铅蓄电池充电时阳极反应式为:PbSO4-2e-+2H2O=PbO2+4H++SO42-
C.粗铜精炼时,与电源正极相连的是纯铜,电极反应式为:Cu-2e-=Cu2+
D.钢铁发生电化学腐蚀的正极反应式:Fe-3e-=Fe3+
科目:高中化学 来源: 题型:
【题目】恒温恒容下,将2mol气体A和2mol气体B通入体积为2L的密闭容器中,发生如下反应:2A(g)+B(g)![]() xC(g)+2D(s),2min后反应达到平衡状态,此时剩余1.2mol B,并测得C的浓度为1.2mol/L。
xC(g)+2D(s),2min后反应达到平衡状态,此时剩余1.2mol B,并测得C的浓度为1.2mol/L。
(1)从开始反应至达到平衡状态,生成C的平均反应速率为 。
(2)x= 。
(3)A的转化率与B的转化率之比为 。
(4)下列各项可作为该反应达到平衡状态的标志是 (填字母)。
A.压强不再变化
B.气体密度不再变化
C.气体平均相对分子质量不再变化
D.A的消耗速率与B的消耗速率之比为2:1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,10mL0.40mol·L-1过氧化氢溶液发生催化分解。不同时刻测得生成氧气的体积(已折算为标准状况)如下表。
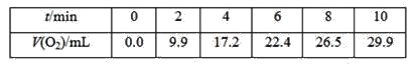
下列叙述不正确的是(溶液体积变化忽略不计)( )
A.0~6min的平均反应速率:v(H2O2)≈3.3×10-2mol·L-1·min-1
B.6~10min的平均反应速率:v(H2O2)<3.3×10-2mol·L-1·min-1
C.反应到6min时,c(H2O2)=0.30mol·L-1
D.反应到6min时,过氧化氢分解了50%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碳元素是形成单质及其化合物种类最多的元素。回答下列问题:
(1)碳能与氢、氮、氧三种元素构成化合物CO(NH2)2,该分子中各元素的电负性由大到小的顺序为_________,其中C原子的杂化方式为__________,该物质易溶于水的主要原因是_______________。
(2)CO是碳元素的常见氧化物,与N2互为等电子体,则CO的结构式为_______;CO可以和很多过渡金属形成配合物,如Ni(CO)4,写出基态Ni原子的电子排布式__________。
(3)碳的某种晶体为层状结构,可与熔融金属钾作用。钾原子填充在各层之间,形成间隙化合物,其常见结构的平面投影如图①所示,则其化学式可表示为__________

(4)图②为碳的一种同素异形体C60分子,每个C60分子中含有σ键的数目为________。
(5)图③为碳的另一种同素异形体金刚石的晶胞,其中原子坐标参数A为(0,0,0),B为(1/2,0,1/2),C为(1/2,1/2,0);则D原子的坐标参数为__________。
(6)立方氮化硼晶体的结构与金刚石相似,硬度与金刚石相当,晶胞边长为361.5 pm。立方氮化硼的密度是___________g·㎝-3(列出计算式即可,阿伏加徳罗常数为NA)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲、乙、丙三种物质是合成聚酯玻璃钢的基本原料,下列说法中错误的是( )
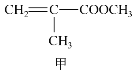
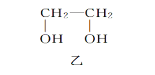
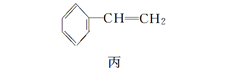
A.1mol乙可与2mol钠完全反应生成1mol氢气
B.三种物质中只有甲和丙能够使酸性高锰酸钾溶液褪色
C.甲和丙在一定条件下发生相同类型的反应
D.乙能与乙二酸反应成环
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知M是短周期金属元素,X和Y是短周期非金属元素,且X、M、Y的原子序数依次增大。三者组成的物质 M3XY(可视为M2X MY)是一种良好的离子导体。研究者在常压下利用下列反应合成M3XY:2M +2MXA + 2MY==2M3XY + A2。其中常温常压下A2是无色无味气体,已知上述反应中消耗0.92 g M的单质可得到标准状况下448 mL的A2。下列有关说法正确的是( )
A.X位于第二周期第IVA族
B.简单离子半径:Y > M > X
C.MXA是共价化合物
D.M3XY溶于水后溶液呈碱性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用下列装置模拟“侯氏制碱法”,通过制备的NH3和CO2,与饱和食盐水反应先制备NaHCO3。下列说法正确的是( )
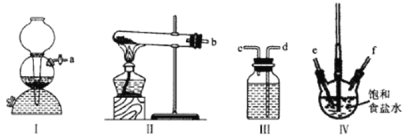
A.实验时装置Ⅰ产生的气体应先通入到装置Ⅳ中
B.装置Ⅲ中的试剂为浓硫酸
C.导管口的连接顺序为a-e-f-d-c-b
D.实验过程中,装置Ⅳ内会出现浑浊现象
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】目前工业上处理有机废水的一种方法是:在调节好pH和Mn2+浓度的废水中加入H2O2,使有机物氧化降解。现设计如下对比实验(实验条件见下表),实验测得有机物R浓度随时间变化的关系如下图所示。下列说法正确的是
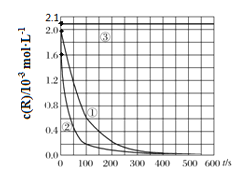
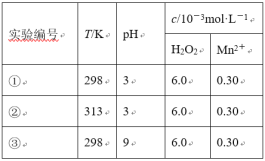
A.313K时,在0~100s内有机物R降解的平均速率为:0.014 mol·L-1·s-1
B.对比①②实验,可以得出温度越高越有利于有机物R的降解
C.对比①②实验,可以发现在两次实验中有机物R的降解百分率不同
D.通过以上三组实验,若想使反应停止,可以向反应体系中加入一定量的NaOH溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,A是常见的金属单质、单质B是黄绿色气体、单质C是无色气体。在合适反应条件下,它们可以按下面框图进行反应;E溶液是无色溶液,F是淡绿色溶液,B和C反应发出苍白色火焰。请回答:
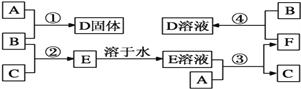
(1)A是_________,B是_________,C是_________![]() 填写化学式
填写化学式![]() ;
;
(2)反应①的化学方程式 ______________________________________;
(3)反应③的离子方程式 _____________________________________;
(4)反应④的离子方程式 ______________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com