
【题目】一定温度下,10mL0.40mol·L-1过氧化氢溶液发生催化分解。不同时刻测得生成氧气的体积(已折算为标准状况)如下表。
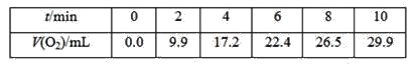
下列叙述不正确的是(溶液体积变化忽略不计)( )
A.0~6min的平均反应速率:v(H2O2)≈3.3×10-2mol·L-1·min-1
B.6~10min的平均反应速率:v(H2O2)<3.3×10-2mol·L-1·min-1
C.反应到6min时,c(H2O2)=0.30mol·L-1
D.反应到6min时,过氧化氢分解了50%
【答案】C
【解析】
A.由2H2O2![]() 2H2O+O2↑知,0~6 min,产生V(O2)=22.4 mL,
2H2O+O2↑知,0~6 min,产生V(O2)=22.4 mL,![]() ,消耗n(H2O2)=2.0×10-3mol,v(H2O2)=
,消耗n(H2O2)=2.0×10-3mol,v(H2O2)=![]() ≈3.3×10-2mol·L-1·min-1,故A正确;
≈3.3×10-2mol·L-1·min-1,故A正确;
B. 随着反应进行,反应物浓度减小,平均反应速率逐渐减小,故6~10 min平均反应速率v(H2O2)<3.3×10-2mol·L-1·min-1,故B正确;
C. 反应到6 min时,消耗n(H2O2)=2.0×10-3mol,则剩余H2O2浓度为0.2 mol·L-1,故C错误;
D. 反应至6 min,4.0×10-3mol的H2O2分解了2.0×10-3mol,分解了50%,故D正确;
答案选C。


科目:高中化学 来源: 题型:
【题目】(1)某学习小组用0.80 mol/L标准浓度的烧碱溶液测定未知浓度的盐酸。
①用滴定的方法来测定盐酸的浓度,实验数据如下所示:
实验编号 | 待测HCl溶液的体积/mL | 滴入NaOH溶液的体积/mL |
1 | 20.00 | 22.00 |
2 | 20.00 | 22.10 |
3 | 20.00 | 21.90 |
该未知盐酸的浓度为_____________(保留两位有效数字)
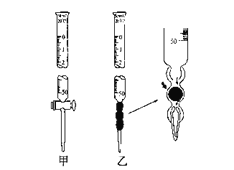
②滴定管如下图所示,用___________滴定管盛装标准浓度的氢氧化钠溶液 (填“甲”或“乙”)。
③下列操作会使所测得的盐酸的浓度偏低的是______________。
A.盛装待测液的锥形瓶用水洗后未干燥
B.滴定前,碱式滴定管尖端有气泡,滴定后气泡消失
C.碱式滴定管用蒸馏水洗净后,未用标准氢氧化钠溶液润洗
D.读碱式滴定管的刻度时,滴定前仰视凹液面最低处,滴定后俯视读数
(2)某课外活动小组为了测定某氯化锶(SrCl2)样品的纯度,设计了如下方案:
称取1.0 g样品溶解于适量水中,向其中加入含AgNO32.38 g的AgNO3溶液(溶液中除Cl-外,不含其他与Ag+反应生成沉淀的离子),Cl-即被全部沉淀。然后用含Fe3+的溶液作指示剂,用0.2 mol·L-1的NH4SCN标准溶液滴定剩余的AgNO3,使剩余的Ag+以AgSCN白色沉淀的形式析出,以测定氯化锶样品的纯度。
请回答下列问题:
①判断滴定达到终点的现象是___________________。
②考虑Ag+和Fe3+在酸或碱性溶液中的存在形式,在实施滴定的溶液以呈_____________(选填“酸性”“中性”或“碱性”)为宜。
③在终点到达之前的滴定过程中,两种沉淀表面会吸附部分Ag+,需不断剧烈摇动锥形瓶,否则会使n(Cl-)的测定结果_____________(选填“偏高”、“偏低”或“无影响”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知在1×105Pa,298K条件下,2mol氢气燃烧生成水蒸气放出484kJ热量,下列热化学方程式正确的是
A. H2O(g)=H2(g)+![]() O2(g) △H=+484kJ/mol
O2(g) △H=+484kJ/mol
B. 2H2(g)+O2(g)=2H2O(l) △H=-484kJ/mol
C. H2(g)+![]() O2(g)=H2O(l) △H=+242kJ/mol
O2(g)=H2O(l) △H=+242kJ/mol
D. H2O(g)=H2(g)+![]() O2(g) △H=+242kJ/mol
O2(g) △H=+242kJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有效去除大气中的NOx,保护臭氧层,是环境保护的重要课题。
(1)在没有NOx催化时,O3的分解可分为以下两步反应进行;
①O3=O+O2 (慢) ②O+O3=2O2 (快)
第一步的速率方程为v1=k1c(O3),第二步的速率方程为v2=k2c(O3)·c(O)。其中O为活性氧原子,它在第一步慢反应中生成,然后又很快的在第二步反应中消耗,因此,我们可以认为活性氧原子变化的速率为零。请用k1、k2组成的代数式表示c(O)=____________。
(2)NO做催化剂可以加速臭氧反应,其反应过程如图所示:
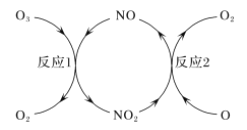
已知:O3(g)+O(g)=2O2(g) ΔH=-143 kJ/mol
反应1:O3(g)+NO(g)=NO2(g)+O2(g) ΔH1=-200.2 kJ/mol。
反应2:热化学方程式为____________________________。
(3)一定条件下,将一定浓度NOx(NO2和NO的混合气体)通入Ca(OH)2悬浊液中,改变![]() ,NOx的去除率如图所示。
,NOx的去除率如图所示。
已知:NO与Ca(OH)2不反应;
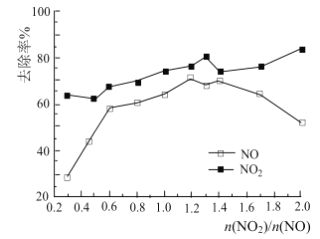
NOx的去除率=1-![]() ×100%
×100%
①![]() 在0.3-0.5之间,NO吸收时发生的主要反应的离子方程式为:___________。
在0.3-0.5之间,NO吸收时发生的主要反应的离子方程式为:___________。
②当![]() 大于1.4时,NO2去除率升高,但NO去除率却降低。其可能的原因是__________。
大于1.4时,NO2去除率升高,但NO去除率却降低。其可能的原因是__________。
(4)若将CO和NO按不同比例投入一密闭容器中发生反应:2CO(g)+2NO(g)=N2(g)+2CO2(g) ΔH=-759.8 kJ/mol,反应达到平衡时,N2的体积分数随![]() 的变化曲线如图。
的变化曲线如图。
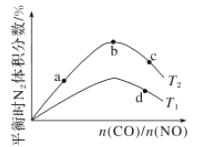
①b点时,平衡体系中C、N原子个数之比接近________。
②a、b、c三点CO的转化率从小到大的顺序为________;b、c、d三点的平衡常数从大到小的顺序为__________(以上两空均用a、b、c、d表示)。
③若![]() =0.8,反应达平衡时,N2的体积分数为20%,则NO的转化率为_____。
=0.8,反应达平衡时,N2的体积分数为20%,则NO的转化率为_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氧化亚铜(Cu2O)是一种用途广泛的光电材料,某工厂以硫化铜矿石(含 CuFeS2、Cu2S等)为原料制取Cu2O的工艺流程如下:
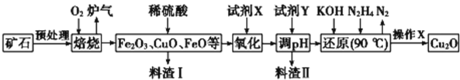
常温下几种物质开始形成沉淀与完全沉淀时的pH如下表:
Fe(OH)2 | Fe(OH)3 | Cu(OH)2 | |
开始沉淀 | 7.5 | 2.7 | 4.8 |
完全沉淀 | 9.0 | 3.7 | 6.4 |
(1)炉气中的有害气体成分是________,Cu2S与O2反应时,氧化剂与还原剂的物质的量之比为______。
(2)试剂X是H2O2溶液,当试剂X是___________时,更有利于降低生产成本。
(3)加入试剂Y调pH时,pH的调控范围是________。
(4)“还原”步骤中为提高N2H4转化率可采取的措施有_________(填序号)。
a.不断搅拌,使N2H4和溶液充分接触 b.增大通入N2H4的流速
c.减少KOH的进入量 d.减小通入N2H4的流速
(5)写出用N2H4制备Cu2O的化学方程式为_______________
(6)操作X包括烘干,其中烘干时要隔绝空气,其目的是____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知白磷和P4O6的分子结构如图所示,又知化学键的键能是形成(或断开)1 mol化学键时释放(或吸收)的能量,现查知P—P键能为198 kJ·mol-1、P—O键能为360 kJ·mol-1、O===O键能为498 kJ·mol-1。若生成1 mol P4O6,则反应P4(白磷)+3O2=P4O6中的能量变化为( )
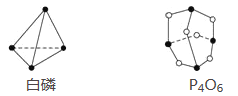
A. 吸收1 638 kJ能量 B. 放出1 638 kJ能量
C. 吸收126 kJ能量 D. 放出126 kJ能量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海洋植物如海带、海藻中含有丰富的碘元素,主要以碘化物形式存在。有一化学课外小组用海带为原料制取少量碘单质,他们将海带灼烧成灰,用水浸泡一段时间(碘化物充分溶解在水中),得到海带灰悬浊液,然后按以下实验流程提取单质碘:(已知:2I-+Cl2=2Cl-+I2)
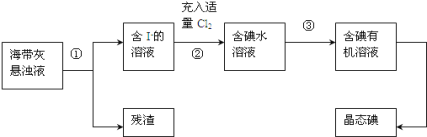
(1)指出提取碘的过程中有关的实验操作名称:①______,③ _____。
(2)过程②中充入适量Cl2的目的是(用方程式解释)_________________,把溶液中的I-转化成I2。
(3)操作③中所用的有机试剂可以是______________(只填一种)。
(4)操作过程③可以分解为如下几步:
A.把盛有溶液的分液漏斗放在铁架台的铁圈中;
B.把50mL碘水和15mL有机溶剂加入分液漏斗中,并盖好玻璃塞;
C.检验分液漏斗活塞和上口的玻璃塞是否漏液;
D.倒转漏斗用力振荡,并不时旋开活塞放气,最后关闭活塞,把分液漏斗放正;
E.旋开活塞,用烧杯接收溶液;
F.从分液漏斗上口倒出上层液体;
G.将漏斗上口的玻璃塞打开或使塞上的凹槽与漏斗上口的小孔对准;
H.静置、分层。
过程③正确操作步骤的顺序是:(填编号字母)_______→________→________→A→H→________→E→F。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学用语是学习化学的重要工具,下列用来表示物质变化的化学用语中,正确的是( )
A.铜作电极材料电解饱和食盐水时总反应为:2H2O+2Cl-![]() Cl2↑+H2↑+2OH-
Cl2↑+H2↑+2OH-
B.铅蓄电池充电时阳极反应式为:PbSO4-2e-+2H2O=PbO2+4H++SO42-
C.粗铜精炼时,与电源正极相连的是纯铜,电极反应式为:Cu-2e-=Cu2+
D.钢铁发生电化学腐蚀的正极反应式:Fe-3e-=Fe3+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是
A.铜与过量的硫粉共热产物是Cu2S
B.Fe(OH)3胶体无色、透明,能发生丁达尔现象
C.我国华为Al芯片已跻身于全球Al芯片榜单前列,该芯片的主要材料是二氧化硅
D.纯锌与稀硫酸反应产生氢气的速率较慢;再加入少量CuSO4固体,速率不改变
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com