
【题目】(1)某学习小组用0.80 mol/L标准浓度的烧碱溶液测定未知浓度的盐酸。
①用滴定的方法来测定盐酸的浓度,实验数据如下所示:
实验编号 | 待测HCl溶液的体积/mL | 滴入NaOH溶液的体积/mL |
1 | 20.00 | 22.00 |
2 | 20.00 | 22.10 |
3 | 20.00 | 21.90 |
该未知盐酸的浓度为_____________(保留两位有效数字)
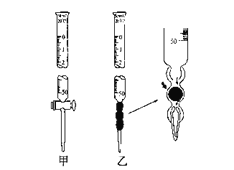
②滴定管如下图所示,用___________滴定管盛装标准浓度的氢氧化钠溶液 (填“甲”或“乙”)。
③下列操作会使所测得的盐酸的浓度偏低的是______________。
A.盛装待测液的锥形瓶用水洗后未干燥
B.滴定前,碱式滴定管尖端有气泡,滴定后气泡消失
C.碱式滴定管用蒸馏水洗净后,未用标准氢氧化钠溶液润洗
D.读碱式滴定管的刻度时,滴定前仰视凹液面最低处,滴定后俯视读数
(2)某课外活动小组为了测定某氯化锶(SrCl2)样品的纯度,设计了如下方案:
称取1.0 g样品溶解于适量水中,向其中加入含AgNO32.38 g的AgNO3溶液(溶液中除Cl-外,不含其他与Ag+反应生成沉淀的离子),Cl-即被全部沉淀。然后用含Fe3+的溶液作指示剂,用0.2 mol·L-1的NH4SCN标准溶液滴定剩余的AgNO3,使剩余的Ag+以AgSCN白色沉淀的形式析出,以测定氯化锶样品的纯度。
请回答下列问题:
①判断滴定达到终点的现象是___________________。
②考虑Ag+和Fe3+在酸或碱性溶液中的存在形式,在实施滴定的溶液以呈_____________(选填“酸性”“中性”或“碱性”)为宜。
③在终点到达之前的滴定过程中,两种沉淀表面会吸附部分Ag+,需不断剧烈摇动锥形瓶,否则会使n(Cl-)的测定结果_____________(选填“偏高”、“偏低”或“无影响”)。
【答案】0.88 mol·L-1 乙 D 溶液突然变为血红色(或溶液突然由黄色变为红色),且半分钟内不变色 酸性 偏高
【解析】
(1)①三次平均消耗的氢氧化钠的体积为(22.00+22.10+21.90)/3=22.00mL,盐酸的浓度c(HCl)=22.00×10-3×0.80/20×10-3mol·L-1=0.88 mol·L-1;
②酸式滴定管盛放酸性溶液,碱式滴定管盛放碱性溶液,甲是酸性滴定管,乙是碱式滴定管,因此用乙盛放氢氧化钠溶液;
③根据c(HCl)=c(NaOH)×V(NaOH)/V(HCl),
A、锥形瓶用水洗后为干燥,待测液的物质的量不变,因此所测盐酸的浓度不变,故错误;
B、滴定前有气泡,滴定后气泡消失,V(NaOH)的增大,则所测盐酸的浓度偏高,故错误;
C、未用标准液润洗,对标准液稀释,c(NaOH)降低,V(NaOH)增大,所测盐酸浓度偏高,故错误;
D、这样读出的氢氧化钠的体积比实际少,其他不变,所测盐酸的浓度偏低,故正确;
答案选D。
(2)①根据题意,用NH4SCN滴定AgNO3溶液,用Fe3+作指示剂,滴定到终点溶液的颜色为血红色,因此滴定中终点的现象:溶液突然变为血红色(或溶液突然由黄色变为红色),且半分钟内不变色;
②Fe3+、Ag+都水解,防止其水解,要求溶液显酸性,抑制它们的水解,故滴定的溶液呈酸性;
③两次沉淀的反应为:Ag++Cl-=AgCl↓,Ag++SCN-=AgSCN↓,第一次AgCl上附着Ag+,剩余Ag+物质的量减少,总量不变,所测c(Cl-)偏高,第二次AgSCN上附着Ag+,消耗的NH4SCN的量减小,所测的剩余的Ag+量减少,则和Cl-反应的Ag+增多,因此c(Cl-)将会偏高。


科目:高中化学 来源: 题型:
【题目】下列既属于置换反应又属于放热反应的是
A.HCl+KOH=KCl+H2OB.4Na+O2=2Na2O
C.C+H2O![]() CO+H2D.2Mg+CO2
CO+H2D.2Mg+CO2![]() 2MgO+C
2MgO+C
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物HIn在水溶液中因存在以下电离平衡,故可用作酸碱指示剂:HIn(红色)![]() H++In-(黄色)。浓度为0.02mol·L-1的下列各溶液:①盐酸 ②石灰水 ③食盐水 ④NaHSO4溶液 ⑤纯碱溶液 ⑥氨水。其中能使指示剂显红色的是( )
H++In-(黄色)。浓度为0.02mol·L-1的下列各溶液:①盐酸 ②石灰水 ③食盐水 ④NaHSO4溶液 ⑤纯碱溶液 ⑥氨水。其中能使指示剂显红色的是( )
A.①④⑤B.②⑤⑥C.①④D.②③⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁是人类较早使用的金属之一,铁及其化合物之间的相互转化作用可用下式表示:
Fe2+ ![]() Fe3+
Fe3+ ![]() FeO42-(高铁酸根离子)
FeO42-(高铁酸根离子)
回答下列有关问题:
(1)向沸水中逐滴滴加1mol/LFeCl3溶液,至液体呈透明的红褐色,形成该分散系的微粒大小范围是______nm。
(2)电子工业需用30%的FeCl3溶液腐蚀敷在绝缘板上的铜,生成FeCl2和CuCl2,制造印刷电路板。写出FeCl3溶液腐蚀铜的化学反应方程式:_____________。检验反应后溶液中还存在Fe3+的试剂是__________。
(3)在下列化学方程式中:2Fe(OH)3+3NaClO+4NaOH=2Na2FeO4+3NaCl+5H2O还原剂是_______________,生成1molNa2FeO4转移电子数目为__________![]() 。
。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】俗名为“臭碱”的硫化钠广泛应用于冶金染料、皮革、电镀等工业。硫化钠的一种制备方法是Na2SO4+2C![]() Na2S+2CO2↑。下列有关说法正确的是( )(设NA表示阿伏加德罗常数的值)
Na2S+2CO2↑。下列有关说法正确的是( )(设NA表示阿伏加德罗常数的值)
A.Na2SO4和Na2S均为离子晶体,晶体中每个SO![]() 或S2-周围均有2个Na+
或S2-周围均有2个Na+
B.C(金刚石)属于共价晶体,1mol该晶体中含的σ键数目为4NA
C.生成1mol氧化产物时转移电子数为4NA
D.标准状况下22.4LCO2中含π键的数目为NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式正确的是( )
A.硅酸钠溶液与盐酸反应![]() +2HCl=2Cl-+ H2O+SiO2↓
+2HCl=2Cl-+ H2O+SiO2↓
B.水玻璃中通入过量二氧化碳![]() +CO2+H2O=
+CO2+H2O=![]() +H2SiO3↓
+H2SiO3↓
C.硅酸与氢氧化钠溶液反应H2SiO3+ OH-=![]() + H2O
+ H2O
D.SiO2与氢氧化钠溶液反应SiO2+2OH-=![]() +H2O
+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮氧化物(NOx)是有毒的大气污染物,研究发现,可以采用如图装置有效去除氮的氧化物,下列说法正确的是( )
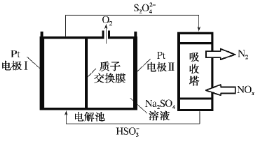
A.Pt电极II比Pt电极I电势低
B.电解过程中,Pt电极I上发生反应:2HSO![]() +2e-=S2O
+2e-=S2O![]() +2OH-
+2OH-
C.电解过程中,左极室pH会逐渐减小
D.转移1mol电子时,吸收塔中消耗0.5molS2O![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】恒温恒容下,将2mol气体A和2mol气体B通入体积为2L的密闭容器中,发生如下反应:2A(g)+B(g)![]() xC(g)+2D(s),2min后反应达到平衡状态,此时剩余1.2mol B,并测得C的浓度为1.2mol/L。
xC(g)+2D(s),2min后反应达到平衡状态,此时剩余1.2mol B,并测得C的浓度为1.2mol/L。
(1)从开始反应至达到平衡状态,生成C的平均反应速率为 。
(2)x= 。
(3)A的转化率与B的转化率之比为 。
(4)下列各项可作为该反应达到平衡状态的标志是 (填字母)。
A.压强不再变化
B.气体密度不再变化
C.气体平均相对分子质量不再变化
D.A的消耗速率与B的消耗速率之比为2:1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,10mL0.40mol·L-1过氧化氢溶液发生催化分解。不同时刻测得生成氧气的体积(已折算为标准状况)如下表。
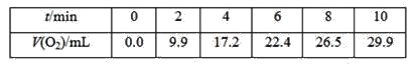
下列叙述不正确的是(溶液体积变化忽略不计)( )
A.0~6min的平均反应速率:v(H2O2)≈3.3×10-2mol·L-1·min-1
B.6~10min的平均反应速率:v(H2O2)<3.3×10-2mol·L-1·min-1
C.反应到6min时,c(H2O2)=0.30mol·L-1
D.反应到6min时,过氧化氢分解了50%
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com