
【题目】已知在1×105Pa,298K条件下,2mol氢气燃烧生成水蒸气放出484kJ热量,下列热化学方程式正确的是
A. H2O(g)=H2(g)+![]() O2(g) △H=+484kJ/mol
O2(g) △H=+484kJ/mol
B. 2H2(g)+O2(g)=2H2O(l) △H=-484kJ/mol
C. H2(g)+![]() O2(g)=H2O(l) △H=+242kJ/mol
O2(g)=H2O(l) △H=+242kJ/mol
D. H2O(g)=H2(g)+![]() O2(g) △H=+242kJ/mol
O2(g) △H=+242kJ/mol
科目:高中化学 来源: 题型:
【题目】化合物HIn在水溶液中因存在以下电离平衡,故可用作酸碱指示剂:HIn(红色)![]() H++In-(黄色)。浓度为0.02mol·L-1的下列各溶液:①盐酸 ②石灰水 ③食盐水 ④NaHSO4溶液 ⑤纯碱溶液 ⑥氨水。其中能使指示剂显红色的是( )
H++In-(黄色)。浓度为0.02mol·L-1的下列各溶液:①盐酸 ②石灰水 ③食盐水 ④NaHSO4溶液 ⑤纯碱溶液 ⑥氨水。其中能使指示剂显红色的是( )
A.①④⑤B.②⑤⑥C.①④D.②③⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮氧化物(NOx)是有毒的大气污染物,研究发现,可以采用如图装置有效去除氮的氧化物,下列说法正确的是( )
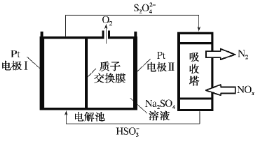
A.Pt电极II比Pt电极I电势低
B.电解过程中,Pt电极I上发生反应:2HSO![]() +2e-=S2O
+2e-=S2O![]() +2OH-
+2OH-
C.电解过程中,左极室pH会逐渐减小
D.转移1mol电子时,吸收塔中消耗0.5molS2O![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】恒温恒容下,将2mol气体A和2mol气体B通入体积为2L的密闭容器中,发生如下反应:2A(g)+B(g)![]() xC(g)+2D(s),2min后反应达到平衡状态,此时剩余1.2mol B,并测得C的浓度为1.2mol/L。
xC(g)+2D(s),2min后反应达到平衡状态,此时剩余1.2mol B,并测得C的浓度为1.2mol/L。
(1)从开始反应至达到平衡状态,生成C的平均反应速率为 。
(2)x= 。
(3)A的转化率与B的转化率之比为 。
(4)下列各项可作为该反应达到平衡状态的标志是 (填字母)。
A.压强不再变化
B.气体密度不再变化
C.气体平均相对分子质量不再变化
D.A的消耗速率与B的消耗速率之比为2:1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学在做原电池原理的实验时,有如下实验步骤:
①用导线将灵敏电流计的两端分别与纯净的锌片和铜片相连接(如图1);
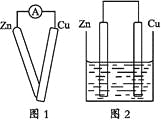
②把一块纯净的锌片插入盛有稀硫酸的烧杯中;
③把一块纯净的铜片插入盛有稀硫酸的烧杯中;
④用导线把锌片和铜片连接起来后,再平行地插入盛有稀硫酸的烧杯中(如图2)。
回答下列问题:
(1)实验步骤①中应观察到的现象是_______________________。
(2)实验步骤②中应观察到的现象是_______________________。
(3)实验步骤③中应观察到的现象是_______________________。
(4)实验步骤④中应观察到的现象是_______________________。
(5)通过实验步骤④该同学头脑中有了一个猜想(或假设),该猜想是_______。
(6)为了证实该猜想,该同学又设计了第⑤步实验,请简要画出第⑤步实验的装置示意图。______
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】近20年来,对以氢气作为未来的动力燃料氢能源的研究获得了迅速发展,像电一样,氢是一种需要依靠其他能源如石油、煤、原子能等的能量来制取的所谓“二级能源”,而存在于自然界的可以提供现成形式能量的能源称为一级能源,如煤、石油、太阳能和原子能。
(1)氢气燃烧时耗氧量小,发热量大。已知,热化学方程式:
C(g)+O2(g)=CO2(g) ΔH=-393.5kJ·mol-1
H2(g)+1/2O2(g)=H2O(l) ΔH=-285.8 kJ·mol-1
试通过计算说明等质量的氢气和碳燃烧时产生热量的比是________。
(2)氢能源有可能实现能源贮存,也有可能实现经济、高效的输送。研究表明在过渡金属型氢化物(又称间充氢化物)中,氢原子填充在金属的晶格间隙之间,其组成不固定,通常是非化学计量的,如LaH2.76、TiH1.73、CeH2.69、ZrH1.98、PrH2.85、TaH0.78。已知标准状况下,1体积的钯粉大约可吸附896体积的氢气(钯粉的密度为10.64g·cm-3,相对原子质量为106.4),试写出钯(Pd)的氢化物的化学式________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组离子在溶液中可以大量共存,且加入或通入试剂X后,发生反应的离子方程式正确的是
选项 | 离子组 | 试剂X | 发生反应的离子方程式 |
A | K+、Na+、 | 少量HCl | H2O+H++ |
B |
| 少量H2S | Fe2++H2S=FeS↓+2H+ |
C | ClO-、Na+、Ca2+、 | 少量CO2 | CO2+Ca2++H2O+2ClO-=CaCO3↓+2HClO |
D | I-、Cl-、Na+、 | 少量稀硝酸 | 6I-+2 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,10mL0.40mol·L-1过氧化氢溶液发生催化分解。不同时刻测得生成氧气的体积(已折算为标准状况)如下表。
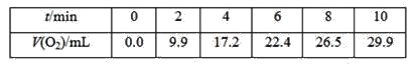
下列叙述不正确的是(溶液体积变化忽略不计)( )
A.0~6min的平均反应速率:v(H2O2)≈3.3×10-2mol·L-1·min-1
B.6~10min的平均反应速率:v(H2O2)<3.3×10-2mol·L-1·min-1
C.反应到6min时,c(H2O2)=0.30mol·L-1
D.反应到6min时,过氧化氢分解了50%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用下列装置模拟“侯氏制碱法”,通过制备的NH3和CO2,与饱和食盐水反应先制备NaHCO3。下列说法正确的是( )
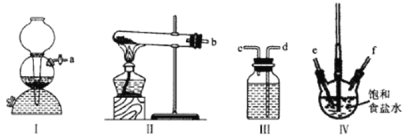
A.实验时装置Ⅰ产生的气体应先通入到装置Ⅳ中
B.装置Ⅲ中的试剂为浓硫酸
C.导管口的连接顺序为a-e-f-d-c-b
D.实验过程中,装置Ⅳ内会出现浑浊现象
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com