
【题目】某同学在做原电池原理的实验时,有如下实验步骤:
①用导线将灵敏电流计的两端分别与纯净的锌片和铜片相连接(如图1);
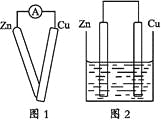
②把一块纯净的锌片插入盛有稀硫酸的烧杯中;
③把一块纯净的铜片插入盛有稀硫酸的烧杯中;
④用导线把锌片和铜片连接起来后,再平行地插入盛有稀硫酸的烧杯中(如图2)。
回答下列问题:
(1)实验步骤①中应观察到的现象是_______________________。
(2)实验步骤②中应观察到的现象是_______________________。
(3)实验步骤③中应观察到的现象是_______________________。
(4)实验步骤④中应观察到的现象是_______________________。
(5)通过实验步骤④该同学头脑中有了一个猜想(或假设),该猜想是_______。
(6)为了证实该猜想,该同学又设计了第⑤步实验,请简要画出第⑤步实验的装置示意图。______
【答案】电流计指针不偏转 锌片上有气泡产生 铜片上无气泡 铜片上有大量气泡,锌片上没有气泡或有少量气泡 有电子从锌经导线向铜片移动 有电子从导线上流过,导线上应形成电流,可以连接一个电流计来证明,实验装置图可设计如下,溶液为稀硫酸。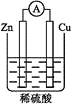
【解析】
形成原电池必须满足下列条件:①两块活泼性不同的金属(或一块金属,一块可导电的非金属)作两极;②电解质溶液;③形成闭合电路;④有自发的氧化还原反应。
(1)没有构成原电池,指针不偏转;
(2)只有锌片,没有构成原电池,锌与稀硫酸直接反应,产生氢气;
(3)只有铜片,没有构成原电池,铜与硫酸不反应,无现象;
(4)构成原电池,锌为负极,逐渐溶解,铜为正极,产生氢气;
(5)构成原电池,外电路有电子(电流)流动;
(6)有电子从导线上流过,导线上应形成电流,可以连接一个电流计来证明,实验装置图可设计如下,溶液为稀硫酸。


 应用题作业本系列答案
应用题作业本系列答案科目:高中化学 来源: 题型:
【题目】化合物G是合成降压药替米沙坦的重要中间体,其人工合成路线如下:
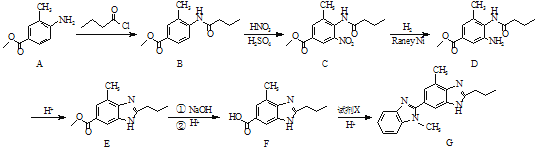
(1)C中含氧官能团的名称为酰胺键、_______和________。
(2)A→B的反应类型为______。
(3)试剂X的分子式为C7H10N2,写出X的结构简式:________。
(4)A的一种同分异构体同时满足下列条件,写出该同分异构体的结构简式:______。
①是α-氨基酸;
②苯环上有3种不同化学环境的氢原子。
(5)已知:①苯胺(![]() )有还原性,易被氧化;
)有还原性,易被氧化;
②硝基苯直接硝化产物为间二硝基苯
③![]()
![]() CH3COO-+CH3NH2
CH3COO-+CH3NH2
写出以![]() 和
和![]() 为原料制备
为原料制备![]() 的合成路线流程图(无机试剂任用,合成路线流程图示例见本题题干)。______________________________
的合成路线流程图(无机试剂任用,合成路线流程图示例见本题题干)。______________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】把2.0 mol·L-1 CuSO4和1.0 mol·L1 H2SO4溶液等体积混合(假设混合后的溶液的体积等于混合前两种溶液的体积之和)计算:
(1)混合溶液中CuSO4和H2SO4的物质的量浓度c(CuSO4)=________;c(H2SO4)=________。
(2)混合液中H+和SO42-的物质的量浓度c(H+)=________;c(SO42-)=________。
(3)向溶液中加入铁粉,经过足够长的时间,铁粉有剩余。此时溶液中的物质的量浓度c(Fe2+)=________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于氮及其化合物的说法,不正确的是
A.硝酸可以与甘油反应生成烈性炸药硝化甘油
B.氯碱工业中可以用氨气检查氯气管道是否泄漏
C.工业上制备硝酸是利用NH3和O2反应生成NO,进一步转化为NO2及HNO3
D.为提高作物的养分,可以是铵态氮肥与碱性肥料混合使用
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图为某种甲醇燃料电池示意图,工作时电子流向如图所示。下列判断正确的是
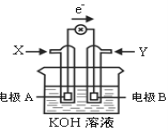
A.X为氧气
B.电极A反应式:CH3OH-6e-+H2O = CO2+6H+
C.B电极附近溶液pH增大
D.电池工作时,溶液中电子由电极B流向电极A
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列事实或操作不符合平衡移动原理的是( )
A. 开启啤酒有泡沫逸出
B. 向FeCl3溶液中加KSCN,有![]() Fe(SCN)3(血红色)+3KCl反应,平衡后向体系中加入KCl固体,使体系红色变浅
Fe(SCN)3(血红色)+3KCl反应,平衡后向体系中加入KCl固体,使体系红色变浅
C. 装有![]() 的烧瓶置于热水中颜色加深
的烧瓶置于热水中颜色加深
D. 实验室用排饱和食盐水的方法收集氯气
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】把0.4molX气体和0.6molY气体混合于2L密闭容器中,使它们发生如下反应:4X(g)+5Y(g) ![]() nZ(g)+6W(g)。2min末已生成0.3molW,若测知以Z的浓度变化表示的反应速率为0.05mol/(L·min),试计算
nZ(g)+6W(g)。2min末已生成0.3molW,若测知以Z的浓度变化表示的反应速率为0.05mol/(L·min),试计算
(1)前2min内用W的浓度变化表示的平均反应速率为_______________。
(2)2min末时Y的浓度为_____________________________。
(3)化学反应方程式中n=_____________________________。
(4)2min末,恢复到反应前温度,体系内压强是反应前压强的__________倍。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知反应2H2(g)+CO(g)![]() CH3OH(g)的平衡常数如下表。按照相同的物质的量投料,
CH3OH(g)的平衡常数如下表。按照相同的物质的量投料,
测得CO在不同温度下的平衡转化率与压强的关系如下图所示。下列大小比较正确的是
平衡常数 | 温度/℃ | ||
500 | 700 | 800 | |
K | 2.50 | 0.34 | 0.15 |
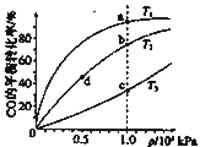
A.平横常数:K(a)>K(c),K(b)=K(d)
B.正反应速率:v(a)>v(c),v(b)=v(d)
C.达到平衡所需时间:t(a)=t(c),t(b)>t(d)
D.平均相对分子质量:M(a)=M(c),M(b)>M(d)
查看答案和解析>>
科目:高中化学 来源: 题型:
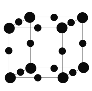
【题目】配合物[Cu(CH3CN)4]BF4[四氟硼酸四(乙腈)合铜(I)]是有机合成中常见催化剂。
(1)Cu+的基态核外电子排布式为___。
(2)BF![]() 的空间构型为___,与其互为等电子体的阴离子是___。
的空间构型为___,与其互为等电子体的阴离子是___。
(3)C、N、B三种元素的电负性由小到大的顺序为___。
(4)[Cu(CH3CN)4]+中配位原子为___。
(5)Cu3N的晶胞结构如图所示,则N3-的配位数为___。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com