
【题目】如图为某种甲醇燃料电池示意图,工作时电子流向如图所示。下列判断正确的是
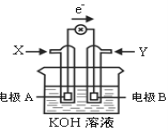
A.X为氧气
B.电极A反应式:CH3OH-6e-+H2O = CO2+6H+
C.B电极附近溶液pH增大
D.电池工作时,溶液中电子由电极B流向电极A
科目:高中化学 来源: 题型:
【题目】下表是A、B、C、D、E五种有机物的有关信息:
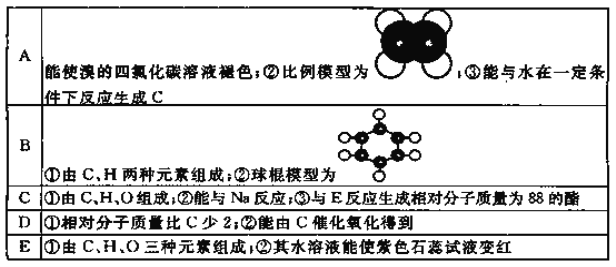
回答下列问题:
(1) A~E中,属于烃的是_____________(填字母)。
(2)A能使溴的四氯化碳溶液褪色,发生反应的化学方程式为___________________。
(3)有机物B具有的性质是_______________________(填序号)。
①无色无味的液体; ②有毒; ③不溶于水; ④密度比水大; ⑤能使酸性KMnO4溶液和溴水褪色
(4)E的水溶液能使紫色石蕊试液变红,说明E的水溶液显酸性,现设计一个实验来比较E与碳酸酸性的强弱,则该实验的原理是:____________________(用化学方程式说明)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在容积为2L的密闭容器中进行如下反应:A(g)+2B(g)![]() 3C(g)+nD(g),开始时A为4mol,B为6mol;5min末时测得C的物质的量为3mol,用D表示的化学反应速率v(D)为0.2mol/(L·min)。计算
3C(g)+nD(g),开始时A为4mol,B为6mol;5min末时测得C的物质的量为3mol,用D表示的化学反应速率v(D)为0.2mol/(L·min)。计算
(1)5min末A的物质的量浓度为__________ mol/L。
(2)前5min内用B表示的化学反应速率v(B)为___________ mol/(L·min)。
(3)化学方程式中n值为__________。
(4)此反应在四种不同情况下的反应速率分别为:
①v(A)=5mol/(L·min)
②v(B)=6mol/(L·min)
③v(C)=4.5mol/(L·min)
④v(D)=8mol/(L·min)
其中反应速率最快的是__________(填编号)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常见锌锰干电池因含有汞、酸或碱等,废弃后进入环境将造成严重危害。某化学兴趣小组拟采用如下处理方法回收废电池中的各种资源。
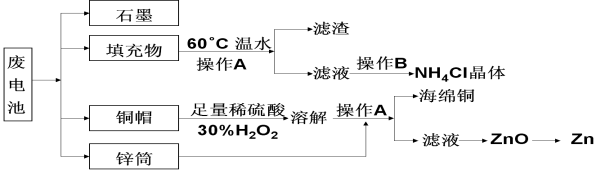
(1)填充物用60℃温水溶解,目的是_____________________。
(2)操作A的名称为______________。
(3)铜帽溶解时加入H2O2的目的是(用化学方程式表示)。铜帽溶解完全后,可采用___________方法除去溶液中过量的H2O2。
(4)碱性锌锰干电池的电解质为KOH,总反应为Zn+2MnO2+2H2O=2MnOOH+Zn(OH)2,其负极的电极反应式为_______________________。
(5)滤渣的主要成分为含锰混合物,向含锰混合物中加入一定量的稀硫酸、稀草酸,并不断搅拌至无气泡为止。主要反应为 __________________________________。
①当1 mol MnO2参加反应时,共有_____________mol电子发生转移。
②MnO(OH)与浓盐酸在加热条件下也可发生反应,试写出该应的化学方程式:_____________。
(6)锌锰干电池所含的汞可用KMnO4溶液吸收。在不同pH下,KMnO4溶液对Hg的吸收率及主要产物如下图所示:

根据上图可知:
①pH对Hg吸收率的影响规律是随pH升高,汞的吸收率_____________________。
②在强酸性环境下Hg的吸收率高的原因可能是_______________KMnO4在酸性条件下强。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】联氨(又称联肼,N2H4,无色液体)是一种应用广泛的化工原料,可用作火箭燃料,回答下列问题:
(4)联氨为二元弱碱,在水中的电离方程式与氨相似,联氨第一步电离反应的平衡常数值为_______(已知:N2H4+H+![]() N2H5+的K=8.7×107;KW=1.0×10-14)。联氨与硫酸形成的酸式盐的化学式为 。
N2H5+的K=8.7×107;KW=1.0×10-14)。联氨与硫酸形成的酸式盐的化学式为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列推断正确的是
A. SiO2是酸性氧化物,能与NaOH溶液反应
B. Na2O、Na2O2组成元素相同,与CO2反应产物也相同
C. CO2, SO2排放到空气中都能形成酸雨,应严格控制排放
D. 新制氯水显酸性,向其中滴加少量紫色石蕊试液,充分振荡后溶液呈红色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮的氧化物(NOx)是大气污染物之一,工业上在一定温度和催化剂条件下用NH3将NOx还原生成N2,某同学在实验室中对NH3与NOx反应进行了探究。回答下列问题:
(1)氨气的制备

①氨气的发生装置可以选择上图中的_________,反应的化学方程式为_______________。
②预收集一瓶干燥的氨气,选择上图中的装置,其连接顺序为:发生装置→______(按气流方向,用小写字母表示)。
(2)氨气与二氧化氮的反应
将上述收集到的NH3充入注射器X中,硬质玻璃管Y中加入少量催化剂,充入NO2(两端用夹子K1、K2夹好)。在一定温度下按图示装置进行实验。

操作步骤 | 实验现象 | 解释原因 |
打开K1,推动注射器活塞,使X中的气体缓慢通入Y管中 | ①Y管中_____________ | ②反应的化学方程式 ____________ |
将注射器活塞退回原处并固定,待装置恢复到室温 | Y管中有少量水珠 | 生成的气态水凝集 |
打开K2 | ③_______________ | ④______________ |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究性学习小组对铝热反应实验展开研究。现行高中化学教材中对“铝热反应”的现象有这样的描述:“反应放出大量的热,并发出耀眼的光芒”、“纸漏斗的下部被烧穿,有熔融物落入沙中”。查阅《化学手册》知,Al、Al2O3、Fe、Fe2O3熔点、沸点数据如下:
物质 | Al | Al2O3 | Fe | Fe2O3 |
熔点/℃ | 660 | 2054 | 1535 | 1462 |
沸点/℃ | 2467 | 2980 | 2750 | -- |
Ⅰ.(1)某同学推测,铝热反应所得到的熔融物应是铁铝合金。理由是:该反应放出的热量使铁熔化,而铝的熔点比铁低,此时液态的铁和铝熔合形成铁铝合金。你认为他的解释是否合理?答:_____ (填“合理”或“不合理”)
(2)设计一个简单的实验方案,证明上述所得的块状熔融物中含有金属铝。该实验所用试剂是_____ ,反应的离子方程式为____ __。
(3)实验室溶解该熔融物,下列试剂中最好的是___ ___(填序号)。
A.浓硫酸 B.稀硫酸 C.稀硝酸 D.氢氧化钠溶液
Ⅱ.实验研究发现,硝酸发生氧化还原反应时,硝酸的浓度越稀,对应还原产物中氮元素的化合价越低。某同学取一定量上述的熔融物与一定量很稀的硝酸充分反应,反应过程中无气体放出。在反应结束后的溶液中,逐滴加入4molL-1的氢氧化钠溶液,所加氢氧化钠溶液的体积(mL)与产生的沉淀的物质的量(mol)的关系如图所示。试回答下列问题:
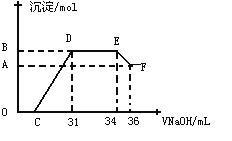
(4)图中OC段没有沉淀生成,此阶段发生反应的离子方程式为______。
(5)在DE段,沉淀的物质的量没有变化,则此阶段发生反应的离子方程式为 ,上述现象说明溶液中____结合OH—的能力比______强(填离子符号)。
(6)B点对应的沉淀的物质的量为____ __mol,C点对应的氢氧化钠溶液的体积为____ __mL。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com