
【题目】常见锌锰干电池因含有汞、酸或碱等,废弃后进入环境将造成严重危害。某化学兴趣小组拟采用如下处理方法回收废电池中的各种资源。
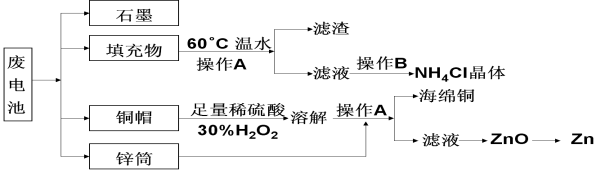
(1)填充物用60℃温水溶解,目的是_____________________。
(2)操作A的名称为______________。
(3)铜帽溶解时加入H2O2的目的是(用化学方程式表示)。铜帽溶解完全后,可采用___________方法除去溶液中过量的H2O2。
(4)碱性锌锰干电池的电解质为KOH,总反应为Zn+2MnO2+2H2O=2MnOOH+Zn(OH)2,其负极的电极反应式为_______________________。
(5)滤渣的主要成分为含锰混合物,向含锰混合物中加入一定量的稀硫酸、稀草酸,并不断搅拌至无气泡为止。主要反应为 __________________________________。
①当1 mol MnO2参加反应时,共有_____________mol电子发生转移。
②MnO(OH)与浓盐酸在加热条件下也可发生反应,试写出该应的化学方程式:_____________。
(6)锌锰干电池所含的汞可用KMnO4溶液吸收。在不同pH下,KMnO4溶液对Hg的吸收率及主要产物如下图所示:

根据上图可知:
①pH对Hg吸收率的影响规律是随pH升高,汞的吸收率_____________________。
②在强酸性环境下Hg的吸收率高的原因可能是_______________KMnO4在酸性条件下强。
【答案】(1)加快溶解速率(1分) (2)过滤(1分)
(3)Cu+H2O2+H2SO4=CuSO4+2H2O(2分) 加热(2分)
(4)Zn+2OH--2e-=Zn(OH)2 (2分) (5)①4(2分)
②2MnO(OH)+6HCl(浓)![]() 2MnCl2+Cl2↑+4H2O (2分)
2MnCl2+Cl2↑+4H2O (2分)
(6)①先降低后增加(1分) ②氧化性(2分)
【解析】
试题分析:(1)由于物质的溶解速率随温度的升高而增大。所以填充物用60℃温水溶解,目的是加快溶解速率;
(2)分离难溶性固体与可溶性液体混合物的操作A的名称为过滤;
(3)Cu不能溶于硫酸,在酸性条件下,加入H2O2的Cu就会被氧化溶解变为Cu2+,反应的化学方程式是:Cu+H2O2+H2SO4=CuSO4+2H2O;H2O2不稳定,受热容易分解产生氧气和水,所以铜帽溶解完全后,可采用加热方法除去溶液中过量的H2O2。
(4)碱性锌锰干电池的电解质为KOH,总反应为Zn+2MnO2+2H2O=2MnOOH+Zn(OH)2,其负极Zn发生氧化反应,电极反应式为Zn+2OH--2e-=Zn(OH)2;
(5)①根据方程式2MnO(OH)+MnO2+2H2C2O4+3H2SO4=2MnSO4+4CO2↑+6H2O可知:当1 mol MnO2参加反应时,共有4mol的电子发生转移;
②MnO(OH)与浓盐酸在加热条件下也可发生反应,则该反应的化学方程式是2MnO(OH)+6HCl(浓)![]() 2MnCl2+Cl2↑+4H2O;
2MnCl2+Cl2↑+4H2O;
(6)①根据在不同pH下,KMnO4溶液对Hg的吸收率的示意图可知:pH对Hg吸收率的影响规律是随pH升高,汞的吸收率先降低后增加;
②在强酸性环境下Hg的吸收率高的原因可能是KMnO4在酸性条件下氧化性强的缘故。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】A、B两种烃,它们含碳质量分数相同,下列关于A和B的叙述正确的是( )
A.A和B一定是同分异构体
B.A和B不可能是同系物
C.A和B最简式一定相同
D.A和B的化学性质相似
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】①~⑩十种元素,在元素周期表中的位置如图所示。回答下列问题:

(1)在上述十种元素中,置换酸中氢的能力最强的元素为 (填化学符号,下同);最高价氧化物的水化物的酸性最强的化合物的化学式是 ,碱性最强的化合物的化学式是 ,显两性的氢氧化物的化学式是 ;原子半径最大的元素是 ,半径最小的离子是 。
(2)上述十种元素中,金属性最强的元素在周期表中的位置是第 周期 族,该元素的单质在空气中燃烧的化学方程式为 。
(3)试用电子式表示元素①和③形成分子的过程 。
查看答案和解析>>
科目:高中化学 来源: 题型:
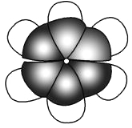
【题目】下列给出了四种烃A、B、C、D的相关信息:
①烃A在所有的烃中含碳的质量分数最低;
②烃B是一种植物生长调节剂,可用于催熟果实;
③烃C在氧气中燃烧产生的氧炔焰常用来切割或焊接金属;
④烃D的分子比例模型如图所示。
据此回答下列问题:
(1)写出A与氯气光照下反应的化学方程式(只写第一步)为 ;
(2)将1mol A和适量的Cl2混合后光照,测得所得所有有机取代产物物质的量相等,则消耗的氯气物质的量是____________。
(3)写出B与水在催化剂作用下反应的化学方程式: 。
(4)写出C与足量溴的四氯化碳溶液反应的化学方程式: 。
(5)D分子中不存在一般的碳碳单键和碳碳双键交替的结构,以下能证实这一事实的是 。
a.D的邻位二氯取代物不存在同分异构体
b.D的间位二氯取代物不存在同分异构体
c.D 不能使溴的四氯化碳溶液褪色
d.D不能被酸性高锰酸钾溶液氧化
e.D在催化剂作用下能与氢气发生加成反应
(6)写出D与浓硝酸、浓硫酸混合后加热至50℃~60℃反应的化学方程式:___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Mg-AgCl电池是一种以海水为电解质溶液的水激活电池,下列叙述错误的是
A.负极反应式为Mg-2e-=Mg2+
B.正极反应式为Ag++e-=Ag
C.电池放电时Cl-由正极向负极迁移
D.负极会发生副反应Mg+2H2O=Mg(OH)2+H2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图为某种甲醇燃料电池示意图,工作时电子流向如图所示。下列判断正确的是
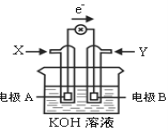
A.X为氧气
B.电极A反应式:CH3OH-6e-+H2O = CO2+6H+
C.B电极附近溶液pH增大
D.电池工作时,溶液中电子由电极B流向电极A
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某溶液加入金属铝能放出氢气。下列各组离子在该溶液中一定可以大量共存的是
A.Al3+、NH4+、Cl-、SO42-
B.Na+、Cl-、SO42-、HCO3-
C.Na+、CH3COO-、NO3- 、K+
D.K+、Na+、Cl-、SO42-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】依据事实写出下列反应的热化学方程式。
(1)在25 ℃、101 kPa下,1 g甲醇燃烧生成CO2和液态水时放热22.68 kJ。则表示甲醇燃烧热的热化学方程式为____________________________________________。
(2)若适量的N2和O2完全反应,每生成23 g NO2需要吸收16.95 kJ热量,则表示N2和O2反应生成NO2的热化学方程式为________________________________________。
(3)已知拆开1 mol H—H键,1 mol N—H键,1 mol N≡N键分别需要吸收的能量是436 kJ、391 kJ、946 kJ,则N2与H2反应生成NH3的热化学方程式为_______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】 两份铝屑,第一份与过量的盐酸反应,第二份与过量的NaOH溶液反应,产生氢气的体积比为1:2,则第一份与第二份铝屑的质量比为
A. 1:1 B. 1:2 C. 1:3 D. 1:4
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com