
【题目】A、B两种烃,它们含碳质量分数相同,下列关于A和B的叙述正确的是( )
A.A和B一定是同分异构体
B.A和B不可能是同系物
C.A和B最简式一定相同
D.A和B的化学性质相似
科目:高中化学 来源: 题型:
【题目】“神舟七号”所用动力燃料之一为氢化锂“三兄弟”——LiH、LiD、LiT。有关LiH、LiD、LiT叙述正确的是( )
A. 质子数之比为1∶2∶3
B. 中子数之比为1∶1∶1
C. 摩尔质量之比为8∶9∶10
D. 化学性质不相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Na2CO3俗称纯碱,是基本化工原料。下列涉及Na2CO3的方程式中,正确的是( )
A.Na2O2与CO2反应生成Na2CO3 Na2O2 +CO2 = Na2CO3 +O2
B.Na2CO3溶液呈碱性 CO32-+H2O ![]() H2CO3+OH-
H2CO3+OH-
C.Na2CO3溶液除去CH3COOC2H5中的CH3COOH CO32-+2H+= CO2↑+H2O
D.饱和Na2CO3溶液处理水垢中的CaSO4 CO32-+CaSO4 = CaCO3+SO42-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】①分别按下图甲、乙所示装置进行实验,图中两个烧杯里的溶液为同浓度的稀硫酸,乙中G为电流计。请回答下列问题:
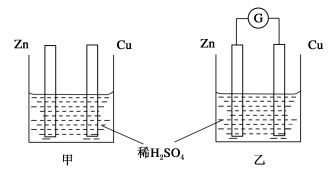
(1)以下叙述中,正确的是__________。
A.甲中锌片是负极,乙中铜片是正极
B.两烧杯中铜片表面均有气泡产生
C.两烧杯中溶液pH均增大
D.产生气泡的速度甲中比乙中慢
E.乙的外电路中电流方向Zn→Cu
(2)变化过程中能量转化的形式主要是:甲为__________;乙为__________。
(3)在乙实验中,如果把硫酸换成硫酸铜溶液,请写出铜电极的电极反应方程式:_____________________________________________________________
②氢氧燃料电池,是一种高效无污染的清洁电池它分碱性(用KOH做电解质)和酸性(用硫酸做电解质)氢氧燃料电池,
(1)如果是碱性燃料电池则负极反应方程式是: .
(2)如果是酸性燃料电池则负极反应方程式是: .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲、乙、丙、丁、戊的相互转化关系如图所示(反应条件略去,箭头表示一步转化)。下列各组物质中,不满足下图所示转化关系的是( )

甲 | 乙 | 丙 | 戊 | |
A | NH3 | Cl2 | N2 | H2 |
B | C | SiO2 | CO | CuO |
C | Al(OH)3 | NaOH溶液 | NaAlO2溶液 | CO2 |
D | 乙醇乙酯 | NaOH溶液 | 乙醇 | 乙酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是A、B、C、D、E五种有机物的有关信息:
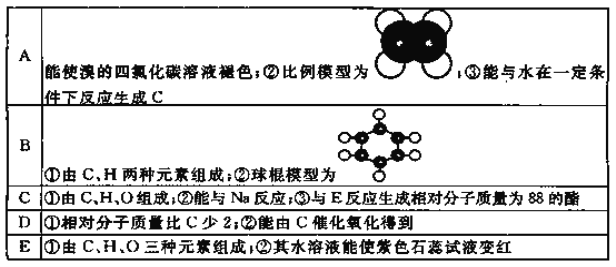
回答下列问题:
(1) A~E中,属于烃的是_____________(填字母)。
(2)A能使溴的四氯化碳溶液褪色,发生反应的化学方程式为___________________。
(3)有机物B具有的性质是_______________________(填序号)。
①无色无味的液体; ②有毒; ③不溶于水; ④密度比水大; ⑤能使酸性KMnO4溶液和溴水褪色
(4)E的水溶液能使紫色石蕊试液变红,说明E的水溶液显酸性,现设计一个实验来比较E与碳酸酸性的强弱,则该实验的原理是:____________________(用化学方程式说明)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A是化学实验室中最常见的有机物,它易溶于水并有特殊香味,并能进行如图所示的多种反应。
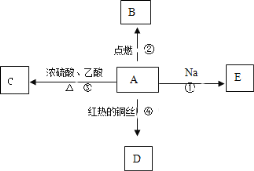
(1)写出A的化学式
(2)下列反应的化学方程式
反应①: .
反应②: .
(3)比较反应①与钠和水反应的现象有什么相同和不同.
相同点: .
不同点: .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某无色溶液中含有K+、Cl-、OH-、SO32-、SO42-,为检验溶液中所含的某些阴离子,限用的试剂有:盐酸、硝酸、硝酸银溶液、硝酸钡溶液、溴水和酚酞试液。检验其中OH-的实验方法省略,检验其他阴离子的过程如下图所示。
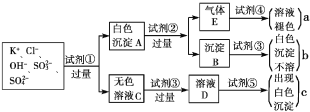
(1)图中试剂①~⑤溶质的化学式分别是
① ,② ,③ ,④ ,⑤ 。
(2)图中现象a、b、c表明检验出的离子分别是a 、b 、c 。
(3)白色沉淀A加试剂②反应的离子方程式是____________________________
(4)无色溶液C加试剂③的主要目的是____________________________
(5)白色沉淀A若加试剂③而不加试剂②,对实验的影响是____________________________
(6)气体E通入试剂④发生反应的离子方程式是____________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常见锌锰干电池因含有汞、酸或碱等,废弃后进入环境将造成严重危害。某化学兴趣小组拟采用如下处理方法回收废电池中的各种资源。
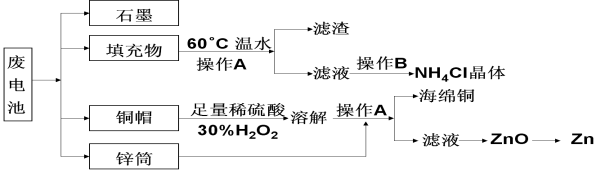
(1)填充物用60℃温水溶解,目的是_____________________。
(2)操作A的名称为______________。
(3)铜帽溶解时加入H2O2的目的是(用化学方程式表示)。铜帽溶解完全后,可采用___________方法除去溶液中过量的H2O2。
(4)碱性锌锰干电池的电解质为KOH,总反应为Zn+2MnO2+2H2O=2MnOOH+Zn(OH)2,其负极的电极反应式为_______________________。
(5)滤渣的主要成分为含锰混合物,向含锰混合物中加入一定量的稀硫酸、稀草酸,并不断搅拌至无气泡为止。主要反应为 __________________________________。
①当1 mol MnO2参加反应时,共有_____________mol电子发生转移。
②MnO(OH)与浓盐酸在加热条件下也可发生反应,试写出该应的化学方程式:_____________。
(6)锌锰干电池所含的汞可用KMnO4溶液吸收。在不同pH下,KMnO4溶液对Hg的吸收率及主要产物如下图所示:

根据上图可知:
①pH对Hg吸收率的影响规律是随pH升高,汞的吸收率_____________________。
②在强酸性环境下Hg的吸收率高的原因可能是_______________KMnO4在酸性条件下强。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com