
【题目】“神舟七号”所用动力燃料之一为氢化锂“三兄弟”——LiH、LiD、LiT。有关LiH、LiD、LiT叙述正确的是( )
A. 质子数之比为1∶2∶3
B. 中子数之比为1∶1∶1
C. 摩尔质量之比为8∶9∶10
D. 化学性质不相同
 备战中考寒假系列答案
备战中考寒假系列答案科目:高中化学 来源: 题型:
【题目】某废催化剂含58.2%的SiO2、21.0%的ZnO、4.5%的ZnS和12.8%的CuS。某同学用15.0 g该废催化剂为原料,回收其中的锌和铜。采用的实验方案如下:
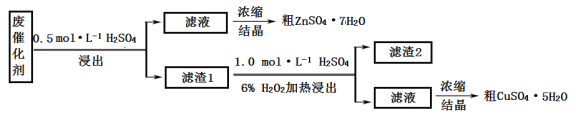
回答下列问题:
(1)在下列装置中,第一次浸出必须用____________,第二次浸出应选用____________。(填标号)
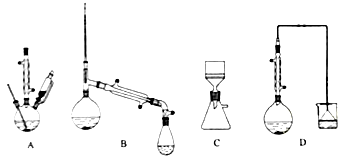
(2)第二次浸出时,向盛有滤液1的反应器中加入稀硫酸,后滴入过氧化氢溶液。若顺序相反,会造成___________。滤渣2的主要成分是____________________。
(3)浓缩硫酸锌、硫酸铜溶液使用的器皿名称是________________。
(4)某同学在实验完成之后,得到1.5gCuSO4﹒5H2O,则铜的回收率为__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验式相同,但既不是同系物,又不是同分异构体的是( )
A.甲醛与甲酸甲酯
B.1-戊烯与2-甲基-1-丙烯
C.1-丁醇与甲醚
D.丙酸与甲酸乙酯
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】无机化合物可根据其组成和性质进行分类:
(1)图所示的物质分类方法名称是_______。
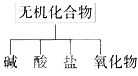
(2)现有氧气、氮气、碳、铜、硫、铁、二氧化碳、氧化镁、水、氯酸钾、空气、碱式碳酸铜等物质,请根据要求填空。
①属于混合物的有 ,属于非金属氧化物的有 。
②属于盐的有 。
③含元素种类最多的化合物是 。
(3)Fe(OH)3胶体中常混有FeCl3和HCl。将其装入半透膜袋,浸入蒸馏水中进行分离。试回答:该分离方法称为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】

(1)该浓盐酸中HCl的物质的量浓度为 mol·L-1。
(2)取用任意体积的该盐酸溶液时,下列物理量中不随所取体积的多少而变化的是 。
A.溶液中HCl的物质的量 | B.溶液的浓度 |
C.溶液中Cl-的数目 | D.溶液的密度 |
(3)某学生欲用上述浓盐酸和蒸馏水配制500 mL物质的量浓度为0.400 mol·L-1的稀盐酸。
①该学生需要量取 mL上述浓盐酸进行配制。
②在配制过程中,下列实验操作对所配制的稀盐酸的物质的量浓度有何影响? (填“偏大”“偏小”或“无影响”)。
a.用量筒量取浓盐酸时俯视观察凹液面: 。
b.定容后经振荡、摇匀、静置,发现液面下降,再加适量的蒸馏水: 。
(4)硅单质是一种重要的非金属单质,其用途是 (举一例)
(5)SiO2和NaOH焙烧制备硅酸钠,可采用的装置为 (填代号)。

(6)某H2中含有2.40 molCO2,该混合气体通入2.00 L NaOH溶液中,CO2被完全吸收。如果NaOH完全反应,该NaOH溶液的浓度为_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是元素周期表的一部分,针对表中的①~⑩中元素,填写下列空格:
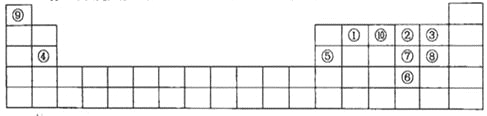
(1)在这10种元素中,非金属性最强的是___________(填序号);
(2)元素②⑧⑨以原子个数比1:1:1形成的化合物的结构式为_________,元素②与⑨形成的18e-化合物的电子式____________________;
(3)②、⑨、⑩三种元素形成的化合物M中原子个数比为3:4:2,电子总数为42,M中含有的化学键类型有___________________________;
(4)比较元素⑦⑧形成的气态氢化物的稳定性:____>____(用化学式表示)。
(5)元素⑤的氧化物与氢氧化钠溶液反应的离子方程式______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,将锌,铜通过导线相连,置于稀硫酸中构成原电池,完成下填空

(1)锌为:________极(填“正”或“负”)电极反应式为:_______________,
(2)反应过程中电流的方向为:____________
A 由铜流向锌 B 由锌流向铜
(3)若有锌片质量减少了0.65g,则转移了____________mol电子发生转移,铜片上产生气体的体积(标况下)为:________________L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E都是元素周期表中的前20号元素,原子序数依次增大,B、C、D同周期,A、D原子中某p能级均排有5个电子,E和其他元素既不在同周期也不在同主族,B、C、D的最高价氧化物的水化物两两混合均能发生反应生成盐和水。
根据以上信息,回答下列问题。
(1)A和D的氢化物中,沸点较低的是________(填化学式);该物质固态时属于________晶体;A和D的电负性较大的是________(填元素符号);B和C的第一电离能较小的是________(填元素符号);
A和B的离子中,半径较小的是________(填离子符号);构成C单质晶体的微粒以________键相结合。
(2)写出B、C的最高价氧化物的水化物相互反应的离子方程式:________________________。
(3)A和E可组成离子化合物,其晶胞结构如图所示:
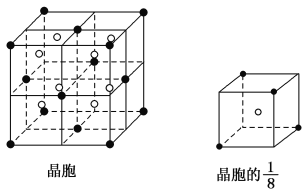
阳离子(用“●”表示)位于大立方体的顶点或面心;阴离子(用“○”表示)均位于小立方体的中心。与一个“○”距离最近的“●”有________个,与一个“●”距离最近的“●”有________个,该化合物的化学式是________。
(4)已知晶胞的![]() 的体积为2.0×10-23cm3,求A和E组成的离子化合物的密度,请列式并计算,结果保留一位小数。
的体积为2.0×10-23cm3,求A和E组成的离子化合物的密度,请列式并计算,结果保留一位小数。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B两种烃,它们含碳质量分数相同,下列关于A和B的叙述正确的是( )
A.A和B一定是同分异构体
B.A和B不可能是同系物
C.A和B最简式一定相同
D.A和B的化学性质相似
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com