
【题目】无机化合物可根据其组成和性质进行分类:
(1)图所示的物质分类方法名称是_______。
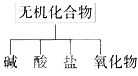
(2)现有氧气、氮气、碳、铜、硫、铁、二氧化碳、氧化镁、水、氯酸钾、空气、碱式碳酸铜等物质,请根据要求填空。
①属于混合物的有 ,属于非金属氧化物的有 。
②属于盐的有 。
③含元素种类最多的化合物是 。
(3)Fe(OH)3胶体中常混有FeCl3和HCl。将其装入半透膜袋,浸入蒸馏水中进行分离。试回答:该分离方法称为 。
 目标测试系列答案
目标测试系列答案科目:高中化学 来源: 题型:
【题目】【2016届邯郸一模】碳铵是一种较常使用的化肥,它在常温下易分解。某化学兴趣小组对碳铵的成分存在疑问,时行了如下探究。
【定性实验】检验溶液中的阴、阳离子
取少量固体放入试管中,加入盐酸,把生成的气体通入澄清石灰水中,有白色沉淀生成.再另取少量碳铵放入试管中,加入浓NaOH溶液,加热,用湿润的红色石蕊试纸检验生成的气体,石蕊试纸变蓝色。
(1)根据实验现象,推测碳铵中所含有阴离子可能是_______和_______;
(2)根据实验现象,碳铵与足量NaOH溶液加热反应的离子方程式可能是__________________;
【定量试验】测定碳铵中C元素和N元素质量比.该兴趣小组准确称取ag碳铵,加热使之分解,并把产物通入碱石灰中,如图所示.
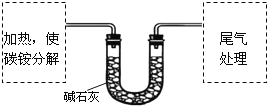
(3)碳铵固体应放在________中进行加热.
A.试管 B.蒸发皿 C.烧瓶 D.坩埚
(4)从安全的角度考虑,尾气处理的装置可以选用________;
(5)若灼烧后没有固体残余,称量U形管在实验前后的质量差为bg.由此测得N元素的质量是_____g。
(6)为了测定碳铵中碳元素的质量,他们设计的实验方案是将ag碳铵完全溶解于水,加入过量BaCl2,然后测定生成沉淀质量.请你评价该方案是否合理;_______(填“合理”“不合理”),理由是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】分子式为C8H16O2的有机物A,能在酸性条件下水解生成有机物C和D,且C在一定条件可被氧化,最终转化成D,则A的可能结构有 ( )
A.2种 B.3种 C.4种 D.5种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究性学习小组对教材中的铁与高温水蒸气反应的实验装置图做了如图所示的优化。通过观察硬质玻璃管Ⅱ和干燥管Ⅱ中的现象证明铁与水蒸气发生了反应,用试管收集产生的经干燥的气体,并靠近火焰点火,观察现象。
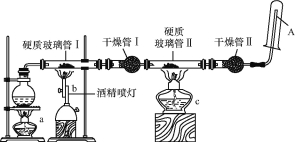
请回答下列问题:
(1)在圆底烧瓶内放入少许碎瓷片,其作用是 。
(2)写出铁与高温水蒸气反应的化学方程式: 。
(3)实验时将铁粉与石棉绒混合放在硬质玻璃管Ⅰ中,其原因可能是 (填“A”“B”或“C”)。
A.石棉绒的作用是催化剂
B.石棉绒的作用是使铁粉受热均匀
C.石棉绒的作用是作铁粉的载体以及防止铁粉被吹入导管引起堵塞
(4)酒精灯a和酒精喷灯点燃的顺序是 ,原因是 。
(5) 能证明铁与水蒸气反应的现象是 。
(6) 试管中收集的气体是氢气,如果要在A处玻璃管处点燃该气体,则必须对该气体进行 ,方法是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】汽车尾气含氮氧化物(NOX)、碳氢化合物(CXHY)、碳等,直接排放容易造成“雾霾”。因此,不少汽车都安装尾气净化装置(净化处理过程如图)。下列有关叙述,错误的是( )

A.尾气造成“雾霾”与汽油未充分燃烧有关
B.尾气处理过程,氮氧化物(NOX)被还原
C.Pt-Rh催化剂可提高尾气净化反应的平衡转化率
D.使用氢氧燃料电池作汽车动力能有效控制雾霾
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组内物质反应产生的气体分别通入FeSO4溶液中,能与FeSO4发生反应的是( )
① Na2O2和H2O ② Al和NaOH溶液 ③ MnO2和浓盐酸共热 ④ 铜片和浓硫酸共热
A. 只有①② B. 只有①③ C. 只有②③ D. 只有③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“神舟七号”所用动力燃料之一为氢化锂“三兄弟”——LiH、LiD、LiT。有关LiH、LiD、LiT叙述正确的是( )
A. 质子数之比为1∶2∶3
B. 中子数之比为1∶1∶1
C. 摩尔质量之比为8∶9∶10
D. 化学性质不相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用零价铁(Fe)去除水体中的硝酸盐(NO3-)已成为环境修复研究的热点之一。
(1)Fe还原水体中NO3-的反应原理如图所示。
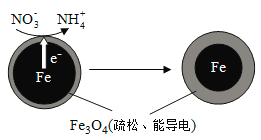
①作负极的物质是________。
②正极的电极反应式是_________。
(2)将足量铁粉投入水体中,经24小时测定NO3—的去除率和pH,结果如下:
初始pH | pH=2.5 | pH=4.5 |
NO3—的去除率 | 接近100% | <50% |
24小时pH | 接近中性 | 接近中性 |
铁的最终物质形态 |
|
|
pH=4.5时,NO3—的去除率低。其原因是________。
(3)实验发现:在初始pH=4.5的水体中投入足量铁粉的同时,补充一定量的Fe2+可以明显提高NO3—的去除率。对Fe2+的作用提出两种假设:
Ⅰ. Fe2+直接还原NO3—;
Ⅱ. Fe2+破坏FeO(OH)氧化层。
①做对比实验,结果如图所示,可得到的结论是_______。
②同位素示踪法证实Fe2+能与FeO(OH)反应生成Fe3O4。结合该反应的离子方程式,解释加入Fe2+提高NO3—去除率的原因:______。
pH =4.5(其他条件相同)

(4)其他条件与(2)相同,经1小时测定NO3—的去除率和pH,结果如下:
初始pH | pH=2.5 | pH=4.5 |
NO3—的去除率 | 约10% | 约3% |
1小时pH | 接近中性 | 接近中性 |
与(2)中数据对比,解释(2)中初始pH不同时,NO3—去除率和铁的最终物质形态不同的原因:__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】①分别按下图甲、乙所示装置进行实验,图中两个烧杯里的溶液为同浓度的稀硫酸,乙中G为电流计。请回答下列问题:
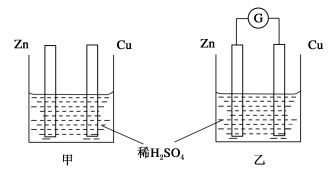
(1)以下叙述中,正确的是__________。
A.甲中锌片是负极,乙中铜片是正极
B.两烧杯中铜片表面均有气泡产生
C.两烧杯中溶液pH均增大
D.产生气泡的速度甲中比乙中慢
E.乙的外电路中电流方向Zn→Cu
(2)变化过程中能量转化的形式主要是:甲为__________;乙为__________。
(3)在乙实验中,如果把硫酸换成硫酸铜溶液,请写出铜电极的电极反应方程式:_____________________________________________________________
②氢氧燃料电池,是一种高效无污染的清洁电池它分碱性(用KOH做电解质)和酸性(用硫酸做电解质)氢氧燃料电池,
(1)如果是碱性燃料电池则负极反应方程式是: .
(2)如果是酸性燃料电池则负极反应方程式是: .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com