
【题目】下列各组内物质反应产生的气体分别通入FeSO4溶液中,能与FeSO4发生反应的是( )
① Na2O2和H2O ② Al和NaOH溶液 ③ MnO2和浓盐酸共热 ④ 铜片和浓硫酸共热
A. 只有①② B. 只有①③ C. 只有②③ D. 只有③④
 寒假天地重庆出版社系列答案
寒假天地重庆出版社系列答案科目:高中化学 来源: 题型:
【题目】A.B.C.D.E.F六种短周期元素的原子序数依次增大。已知A.C.F三原子的最外层共有11个电子,且这三种元素的最高价氧化物的水化物之间两两皆能反应,均生成盐和水,D元素原子的最外层电子数比次外层电子数少4个,E元素原子的次外层电子数比最外层电子数多3个。试回答:
(1)写出下列元素的符号A___________,D___________,E___________;
(2)用电子式表示B、F形成的化合物___________;
(3)A、C两种元素最高价氧化物的水化物之间反应的离子方程式_____________;
(4)D的固态氧化物是________晶体。含n mol D的氧化物的晶体中含D-O共价键为_______mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CO2是重要的化工原料,也是应用广发的化工产品。CO2与过氧化钠或超氧化钾反应可产生氧气。
完成下列计算:
(1)CO2通入氨水生成NH4HCO3,NH4HCO3很容易分解。2.00 mol NH4HCO3完全分解,分解产物经干燥后的体积为_________L(标准状况)。
(2)某H2中含有2.40 molCO2,该混合气体通入2.00 L NaOH溶液中,CO2被完全吸收。如果NaOH完全反应,该NaOH溶液的浓度为_______。
(3)CO2和KO2有下列反应:
4KO2+2CO2→2K2CO3+3O2
4KO2+4CO2+2H2O→4KHCO3+3O2
若9 mol CO2在密封舱内和KO2反应后生成9 mol O2,则反应前密封舱内H2O的量应该是多少?列式计算。
(4)甲烷和水蒸气反应的产物是合成甲醇的原料:CH4+H2O![]() CO+3H2
CO+3H2
已知:CO+2H2![]() CH3OH CO2+3H2
CH3OH CO2+3H2![]() CH3OH+H2O
CH3OH+H2O
300 mol CH4完全反应后的产物中,加入100 mol CO2后合成甲醇。若获得甲醇350 mol,残留氢气120 mol,计算CO2的转化率。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】无机化合物可根据其组成和性质进行分类:
(1)图所示的物质分类方法名称是_______。
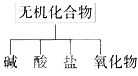
(2)现有氧气、氮气、碳、铜、硫、铁、二氧化碳、氧化镁、水、氯酸钾、空气、碱式碳酸铜等物质,请根据要求填空。
①属于混合物的有 ,属于非金属氧化物的有 。
②属于盐的有 。
③含元素种类最多的化合物是 。
(3)Fe(OH)3胶体中常混有FeCl3和HCl。将其装入半透膜袋,浸入蒸馏水中进行分离。试回答:该分离方法称为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】次磷酸(H3PO2)是一种精细磷化工产品,属于一元弱酸,具有较强的还原性。下列有关说法正确的是( )
A.H3PO2溶于水的电离方程式为:H3PO2![]() H++H2PO2-
H++H2PO2-
B.H3PO2与过量NaOH溶液反应的离子方程式为:H3PO2+3OH-=PO23-+3H2O
C.将H3PO2溶液加入到酸性高锰酸钾溶液中,H3PO2的还原产物为H3PO4
D.用惰性电极电解NaH2PO2溶液,其阳极反应式为:2H2O-4e-=O2↑+4H+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是元素周期表的一部分,针对表中的①~⑩中元素,填写下列空格:
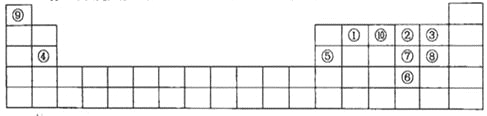
(1)在这10种元素中,非金属性最强的是___________(填序号);
(2)元素②⑧⑨以原子个数比1:1:1形成的化合物的结构式为_________,元素②与⑨形成的18e-化合物的电子式____________________;
(3)②、⑨、⑩三种元素形成的化合物M中原子个数比为3:4:2,电子总数为42,M中含有的化学键类型有___________________________;
(4)比较元素⑦⑧形成的气态氢化物的稳定性:____>____(用化学式表示)。
(5)元素⑤的氧化物与氢氧化钠溶液反应的离子方程式______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
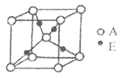
【题目】已知A、B、C、D是原子序数依次减小的四种短周期元素,C的基态原子中电子占据三种能量不同的原子轨道,且每种轨道中的电子总数相同;A原子有2个未成对电子;A、C、D三种元素组成的一种化合物M是新装修居室中常含有的一种有害气体.E是第四周期元素,其原子核外最外层电子数与D原子相同,其余各层电子均充满。
请回答下列问题(用元素符号或化学式表示):
(1)元素B、C、A的基态原子的第一电离能由大到小的顺序为__________________;
(2)M分子中C原子轨道的杂化类型为__________________;
(3)E+的核外电子排布式为__________________1s22s22p63s23p63d10
,下图是由D、E形成的某种化合物的晶胞结构示意图,该化合物的化学式为__________________;
(4)化合物BD3的沸点比化合物CA4的高,其主要原因是__________________;
(5)写出与CA2互为等电子体的B3-的结构式 __________________;
(6)将CrCl3·6H2O溶解在适量水中得到深绿色溶液,溶液中Cr3+以[Cr(H2O)5Cl]2+形式存在。上述溶液中,不存在的微粒间作用力是__________________(填标号)。
A.离子键 B.共价键 C.金属键 D.配位键 E.范德华力
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将5.1g镁铝合金,投入到500mL2.0mol/L的盐酸中,金属完全溶解,再加入4.0mol/LNaOH溶液,若要生成的沉淀最多,则NaOH溶液的体积是
A.200mLB.250mLC.425mLD.560mL
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com