
【题目】【2016届邯郸一模】碳铵是一种较常使用的化肥,它在常温下易分解。某化学兴趣小组对碳铵的成分存在疑问,时行了如下探究。
【定性实验】检验溶液中的阴、阳离子
取少量固体放入试管中,加入盐酸,把生成的气体通入澄清石灰水中,有白色沉淀生成.再另取少量碳铵放入试管中,加入浓NaOH溶液,加热,用湿润的红色石蕊试纸检验生成的气体,石蕊试纸变蓝色。
(1)根据实验现象,推测碳铵中所含有阴离子可能是_______和_______;
(2)根据实验现象,碳铵与足量NaOH溶液加热反应的离子方程式可能是__________________;
【定量试验】测定碳铵中C元素和N元素质量比.该兴趣小组准确称取ag碳铵,加热使之分解,并把产物通入碱石灰中,如图所示.
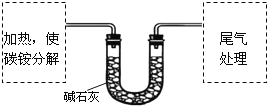
(3)碳铵固体应放在________中进行加热.
A.试管 B.蒸发皿 C.烧瓶 D.坩埚
(4)从安全的角度考虑,尾气处理的装置可以选用________;
(5)若灼烧后没有固体残余,称量U形管在实验前后的质量差为bg.由此测得N元素的质量是_____g。
(6)为了测定碳铵中碳元素的质量,他们设计的实验方案是将ag碳铵完全溶解于水,加入过量BaCl2,然后测定生成沉淀质量.请你评价该方案是否合理;_______(填“合理”“不合理”),理由是________。
【答案】(13分)(1)HCO3-、CO32- (各1分,共2分)
(2)NH4++OH-![]() NH3↑+H2O 或NH4++HCO3-+2OH-
NH3↑+H2O 或NH4++HCO3-+2OH-![]() NH3↑+CO32-+2H2O (2分)
NH3↑+CO32-+2H2O (2分)
(3)A(2分) (4)A(2分) (5)![]() (2分)
(2分)
(6)本小题属于开放性试题,若考生只回答“合理”或“不合理”不给分;若考生回答“合理”或“不合理”且理由能做出相应解释,可酌情给分(3分)。例如:考生回答
①不合理,因为碳铵中可能含有HCO3-,不能与BaCl2产生沉淀,所测得碳元素质量分数不准确。
②合理,因为碳铵中只含有CO32-,加入BaCl2能完全生成沉淀,可准确测得碳元素的质量”。
【解析】
试题分析:【定性实验】取少量固体放入试管中,加入盐酸,把生成的气体通入澄清石灰水中,有白色沉淀生成,白色沉淀为碳酸钙,盐中阴离子可能HCO3-、CO32-;再另取少量碳铵放入试管中,加入浓NaOH溶液,加热,用湿润的红色石蕊试纸检验生成的气体,石蕊试纸变蓝色,则气体为氨气,则原固体中含铵根离子,(1)由上述分析可知,阴离子可能为HCO3-、CO32-;
(2)碳铵与足量NaOH溶液加热反应的离子方程式可能是NH4++OH-=NH3↑+H2O、HCO3-+OH-=CO32-+H2O(或NH4++HCO3-+2OH-=NH3+CO32-+2H2O);
【定量实验】ag碳铵,加热使之分解,碱石灰增重为水和二氧化碳的质量,尾气处理为氨气,(3)因加热装置后连接U形管,则选择仪器只能为试管,故答案为A;
(4)尾气处理,应防止倒吸,B不能防止倒吸,C中气体收集时导管应短进,D中为密闭容器可能会炸裂,只有A装置收集及防倒吸,故答案为A;
(5)灼烧后没有固体残余,称量U形管在实验前后的质量差为bg,则氨气的质量为(a-b)g,则含N质量为![]() g;
g;
(6)ag碳铵完全溶解于水,加入过量BaCl2,然后测定生成沉淀质量,则①不合理,因为碳铵中可能含有HCO3-不能与BaCl2产生沉淀所测得碳元素质量分数不准确;②合理,因为碳铵中只含有CO32-加入BaCl2能完全生成沉淀可准确测得碳元素的质量;③不合理;测得的结果不准确。


科目:高中化学 来源: 题型:
【题目】【2016届济南一模】高锰酸钾是常用的消毒剂、除臭剂、水质净化剂以及强氧化剂,下图是在实验室中制备KMnO4晶体的流程:
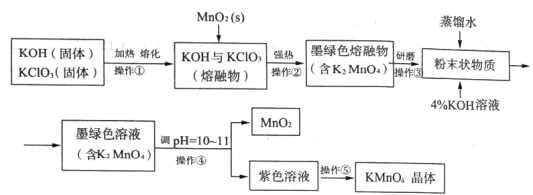
回答下列问题:
(1)操作②目的是获得K2MnO4,同时还产生了KCl和H2O,试写出该步反应的化学方程式: _______________。操作①和②均需在坩埚中进行,根据实验实际应选择_______________(填序号)。
a.瓷坩埚 b.氧化铝坩埚 c.铁坩埚 d.石英坩埚
(2)操作④是使K2MnO4转化为KMnO4和MnO2,该转化过程中发生反应的离子方程式为_______________。若溶液碱性过强,则MnO4-又会转化为MnO42-,该转化过程中发生反应的离子方程式为_______________。因此需要通入某种气体调pH=10-11,在实际操作中一般选择CO2而不是HCl,原因是_______________。
(3)操作⑤过滤时,选择图2所示装置而不用图1所示装置的原因是_______________。
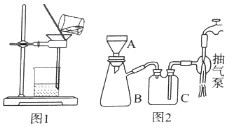
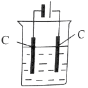
(4)还可采用电解K2MnO4溶液(绿色)的方法制造KMnO4(电解装置如图所示),电解过程中右侧石墨电极的电极反应式为_______________。溶液逐渐由绿色变为紫色。但若电解时间过长,溶液颜色又会转变成绿色,可能的原因是_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国有较长的海岸线,浩瀚的海洋是一个巨大的物质资源和能量的宝库。目前,世界各国都在研究如何充分利用海洋资源。全球海水中的溴的储量丰富,约占地球溴总储量的99%,故溴有“海洋元素”之称,海水中溴含量为65 mg·L-1。其工业提取法有:
Ⅰ.空气吹出纯碱吸收法。方法是将氯气通入到富含溴离子的海水中,使溴置换出来,再用空气将溴吹出,用纯碱溶液吸收,最后用硫酸酸化,即可得到单质溴。该方法涉及的反应有:①Cl2+2Br-===Br2+2Cl-
②3Br2+3C![]() ===Br
===Br![]() +5Br-+3CO2↑;
+5Br-+3CO2↑;
③Br![]() +5Br- +6H+===3Br2+3H2O
+5Br- +6H+===3Br2+3H2O
其中②中的氧化剂是________,③中的还原剂是________。
Ⅱ.空气吹出SO2吸收法。该方法基本同(Ⅰ),只是将吹出的溴用SO2溶液来吸收,使溴转化为氢溴酸,然后再用氯气氧化氢溴酸即得单质溴。
写出溴与二氧化硫反应的化学方程式_________________________________________________。
Ⅲ.溶剂萃取法。该法是利用单质溴在水中和萃取剂中溶解度的不同的原理来进行的。
实验室中萃取用到的主要实验仪器名称是_______________________。
下列可以用于海水中溴的萃取的试剂是________(填序号)。
①乙醇 ②四氯化碳 ③硝酸
查看答案和解析>>
科目:高中化学 来源: 题型:
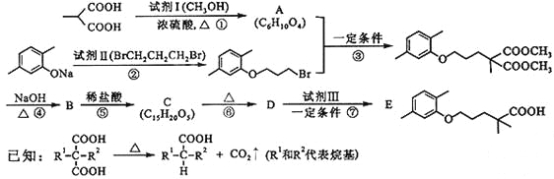
【题目】高血脂严重影响人体健康,化合物E是一种临床治疗高血脂症的药物。E的合成路线如下(部分反应条件和试剂略):
请回答下列问题:
(1)试剂Ⅰ的名称是___a___,试剂Ⅱ中官能团的名称是___b___,第② 步的反应类型是____c___。
(2)第①步反应的化学方程式是_____________。
(3)第⑥步反应的化学方程式是_____________。
(4)第⑦步反应中,试剂Ⅲ为单碘代烷烃,其结构简式是_________ 。
(5)C的同分异构体在酸性条件下水解,生成X、Y和CH3(CH2)4OH。若X含有羧基和苯环,且X和Y的核磁共振氢谱都只有两种类型的吸收峰,则X与Y发生缩聚反应所得缩聚物的结构简式是___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】KAl(SO4)2·12H2O(明矾)是一种复盐,在造纸等方面应用广泛。实验室中,采用废易拉罐(主要成分为Al,含有少量的Fe、Mg杂质)制备明矾的过程如下图所示。回答下列问题:
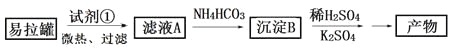
(1)为尽量少引入杂质,试剂①应选用___(填标号)。
a.HCl溶液 b.H2SO4溶液 c.氨水 d.NaOH溶液
(2)易拉罐溶解过程中主要反应的化学方程式为________。
(3)沉淀B的化学式为________;将少量明矾溶于水,溶液呈弱酸性,其原因是__________。
(4)已知:Kw=1.0×10-14,Al(OH)3![]() AlO2-+H++H2O K=2.0×10-13。Al(OH)3溶于NaOH溶液反应的平衡常数等于_________。
AlO2-+H++H2O K=2.0×10-13。Al(OH)3溶于NaOH溶液反应的平衡常数等于_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A.B.C.D.E.F六种短周期元素的原子序数依次增大。已知A.C.F三原子的最外层共有11个电子,且这三种元素的最高价氧化物的水化物之间两两皆能反应,均生成盐和水,D元素原子的最外层电子数比次外层电子数少4个,E元素原子的次外层电子数比最外层电子数多3个。试回答:
(1)写出下列元素的符号A___________,D___________,E___________;
(2)用电子式表示B、F形成的化合物___________;
(3)A、C两种元素最高价氧化物的水化物之间反应的离子方程式_____________;
(4)D的固态氧化物是________晶体。含n mol D的氧化物的晶体中含D-O共价键为_______mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某废催化剂含58.2%的SiO2、21.0%的ZnO、4.5%的ZnS和12.8%的CuS。某同学用15.0 g该废催化剂为原料,回收其中的锌和铜。采用的实验方案如下:
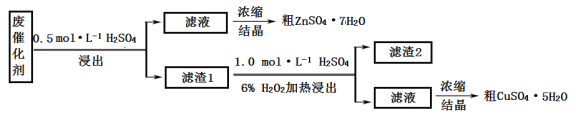
回答下列问题:
(1)在下列装置中,第一次浸出必须用____________,第二次浸出应选用____________。(填标号)
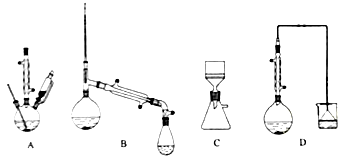
(2)第二次浸出时,向盛有滤液1的反应器中加入稀硫酸,后滴入过氧化氢溶液。若顺序相反,会造成___________。滤渣2的主要成分是____________________。
(3)浓缩硫酸锌、硫酸铜溶液使用的器皿名称是________________。
(4)某同学在实验完成之后,得到1.5gCuSO4﹒5H2O,则铜的回收率为__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯胺是由氯气遇到氨气反应生成的一类化合物,是常用的饮用水二级消毒剂,主要包括一氯胺(NH2Cl)、二氯胺(NHCl2)和三氯胺(NC13) 。氯胺消毒时首先发生水解,生成具有强烈杀菌作用的次氯酸。
(2) NH2Cl中氯元素的化合价为_______,其电子式为________。
(2) NH2Cl水解的离子方程式为____________。
(3)三氯胺在常温下为黄色黏稠的油状液体,有毒,在弱酸性溶液中稳定性较好。将0.01mol NCl3通入100mL0.5mol/LNa2SO3溶液中,转移电子的物质的量为___________。
(4)已知:
2NH3(g)+ 3Cl2(g)=N2(g)+ 6HCl(g) △H1=-469kJ·mol-1
N2(g)+ 3Cl2(g)=2NC13(g) △H2=+520kJ·mol-1
NH3(g)+3Cl2(g)=NC13(g)+3HCl(g) △H3
则△H3=_________ kJ·mol-1。
查看答案和解析>>
科目:高中化学 来源: 题型:
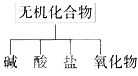
【题目】无机化合物可根据其组成和性质进行分类:
(1)图所示的物质分类方法名称是_______。
(2)现有氧气、氮气、碳、铜、硫、铁、二氧化碳、氧化镁、水、氯酸钾、空气、碱式碳酸铜等物质,请根据要求填空。
①属于混合物的有 ,属于非金属氧化物的有 。
②属于盐的有 。
③含元素种类最多的化合物是 。
(3)Fe(OH)3胶体中常混有FeCl3和HCl。将其装入半透膜袋,浸入蒸馏水中进行分离。试回答:该分离方法称为 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com