
【题目】A、B、C、D、E都是元素周期表中的前20号元素,原子序数依次增大,B、C、D同周期,A、D原子中某p能级均排有5个电子,E和其他元素既不在同周期也不在同主族,B、C、D的最高价氧化物的水化物两两混合均能发生反应生成盐和水。
根据以上信息,回答下列问题。
(1)A和D的氢化物中,沸点较低的是________(填化学式);该物质固态时属于________晶体;A和D的电负性较大的是________(填元素符号);B和C的第一电离能较小的是________(填元素符号);
A和B的离子中,半径较小的是________(填离子符号);构成C单质晶体的微粒以________键相结合。
(2)写出B、C的最高价氧化物的水化物相互反应的离子方程式:________________________。
(3)A和E可组成离子化合物,其晶胞结构如图所示:
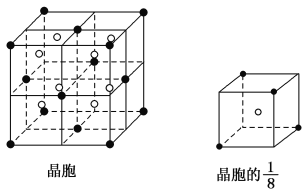
阳离子(用“●”表示)位于大立方体的顶点或面心;阴离子(用“○”表示)均位于小立方体的中心。与一个“○”距离最近的“●”有________个,与一个“●”距离最近的“●”有________个,该化合物的化学式是________。
(4)已知晶胞的![]() 的体积为2.0×10-23cm3,求A和E组成的离子化合物的密度,请列式并计算,结果保留一位小数。
的体积为2.0×10-23cm3,求A和E组成的离子化合物的密度,请列式并计算,结果保留一位小数。
【答案】 (1)HCl 分子 F Na Na+ 金属
(2)OH-+Al(OH)3===AlO2-+2H2O
(3)4 12 CaF2
(4)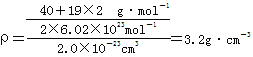
【解析】
试题分析:A、B、C、D、E都是元素周期表中前20号的元素,原子序数依次增大,且B、C、D同周期,B、C、D的最高价氧化物的水化物两两混合均能发生反应生成盐和水,说明C的最高价氧化物的水化物是两性,B的最高价氧化物的水化物呈强碱性,D的最高价氧化物的水化物呈酸性,所以C是Al元素,B是Na元素,D是S元素或Cl元素;E和其它元素既不在同周期也不在同主族,所以E是Ca元素;晶胞中阳离子个数=8×1/8+6×1/2=4,阴离子为8,阴阳离子个数之比=8:4=2:1,所以其化学式为EA2,E是Ca元素, A、D同主族,所以A是F元素,D是Cl元素。
(1)A和D的氢化物分别为HF和HCl,中,氟化氢和氯化氢形成的晶体都是分子晶体,但氟化氢中分子间存在氢键,氯化氢分子间不存在氢键,氢键的存在导致氟化氢的沸点反常高,所以沸点较低的是HCl;该物质固态时属于分子晶体;同主族元素,从上到下,非金属性减弱,电负性逐渐减弱,则F和Cl的电负性较大的是F;Na和Al属于同周期元素,同周期元素,从左到右,第一电离能逐渐增大,则Na和Al的第一电离能较小的是Na;F-和Na+的核外电子排布相同,质子数越多,离子半径越小,则Na+和F-中,离子半径较小的是Na+;Al是金属晶体,则构成Al单质晶体的微粒以金属键相结合。
(2)B、C的最高价氧化物的水化物分别为NaOH、Al(OH)3,氢氧化铝是两性氢氧化物,能与强碱反应生成偏铝酸钠和水,它们相互反应的离子方程式为OH-+Al(OH)3===AlO2-+2H2O。
(3)根据晶胞结构可知,与一个“○”距离最近的“●”有4个,与一个“●”距离最近的“●”12个,根据上述推断,该化合物的化学式是CaF2。
(4)已知晶胞的![]() 的体积为2.0×10-23cm3,晶胞的
的体积为2.0×10-23cm3,晶胞的![]() 含
含![]() 个CaF2,其质量是
个CaF2,其质量是![]() ,
,
密度是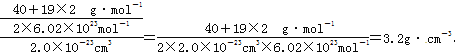 。
。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】分子式为C8H16O2的有机物A,能在酸性条件下水解生成有机物C和D,且C在一定条件可被氧化,最终转化成D,则A的可能结构有 ( )
A.2种 B.3种 C.4种 D.5种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“神舟七号”所用动力燃料之一为氢化锂“三兄弟”——LiH、LiD、LiT。有关LiH、LiD、LiT叙述正确的是( )
A. 质子数之比为1∶2∶3
B. 中子数之比为1∶1∶1
C. 摩尔质量之比为8∶9∶10
D. 化学性质不相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用零价铁(Fe)去除水体中的硝酸盐(NO3-)已成为环境修复研究的热点之一。
(1)Fe还原水体中NO3-的反应原理如图所示。
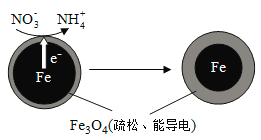
①作负极的物质是________。
②正极的电极反应式是_________。
(2)将足量铁粉投入水体中,经24小时测定NO3—的去除率和pH,结果如下:
初始pH | pH=2.5 | pH=4.5 |
NO3—的去除率 | 接近100% | <50% |
24小时pH | 接近中性 | 接近中性 |
铁的最终物质形态 |
|
|
pH=4.5时,NO3—的去除率低。其原因是________。
(3)实验发现:在初始pH=4.5的水体中投入足量铁粉的同时,补充一定量的Fe2+可以明显提高NO3—的去除率。对Fe2+的作用提出两种假设:
Ⅰ. Fe2+直接还原NO3—;
Ⅱ. Fe2+破坏FeO(OH)氧化层。
①做对比实验,结果如图所示,可得到的结论是_______。
②同位素示踪法证实Fe2+能与FeO(OH)反应生成Fe3O4。结合该反应的离子方程式,解释加入Fe2+提高NO3—去除率的原因:______。
pH =4.5(其他条件相同)

(4)其他条件与(2)相同,经1小时测定NO3—的去除率和pH,结果如下:
初始pH | pH=2.5 | pH=4.5 |
NO3—的去除率 | 约10% | 约3% |
1小时pH | 接近中性 | 接近中性 |
与(2)中数据对比,解释(2)中初始pH不同时,NO3—去除率和铁的最终物质形态不同的原因:__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NaClO2是一种重要的杀菌消毒剂,也常用来漂白织物等,其一种生产工艺如下:

回答下列问题:
(1)NaClO2中Cl的化合价为_______。
(2)写出“反应”步骤中生成ClO2的化学方程式_______。
(3)“电解”所用食盐水由粗盐水精制而成,精制时,为除去Mg2+和Ca2+,要加入的试剂分别为________、________。“电解”中阴极反应的主要产物是______。
(4)“尾气吸收”是吸收“电解”过程排出的少量ClO2。此吸收反应中,氧化剂与还原剂的物质的量之比为________,该反应中氧化产物是_________。
(5)“有效氯含量”可用来衡量含氯消毒剂的消毒能力,其定义是:每克含氯消毒剂的氧化能力相当于多少克Cl2的氧化能力。NaClO2的有效氯含量为____。(计算结果保留两位小数)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关表述正确的是( )
A.离子晶体一定含金属阳离子
B.非金属元素形成的单质一定是分子晶体
C.在共价化合物分子中各原子都形成8电子结构
D.共价键能存在于共价化合物中,也能存在于离子化合物中
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Na2CO3俗称纯碱,是基本化工原料。下列涉及Na2CO3的方程式中,正确的是( )
A.Na2O2与CO2反应生成Na2CO3 Na2O2 +CO2 = Na2CO3 +O2
B.Na2CO3溶液呈碱性 CO32-+H2O ![]() H2CO3+OH-
H2CO3+OH-
C.Na2CO3溶液除去CH3COOC2H5中的CH3COOH CO32-+2H+= CO2↑+H2O
D.饱和Na2CO3溶液处理水垢中的CaSO4 CO32-+CaSO4 = CaCO3+SO42-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】①分别按下图甲、乙所示装置进行实验,图中两个烧杯里的溶液为同浓度的稀硫酸,乙中G为电流计。请回答下列问题:
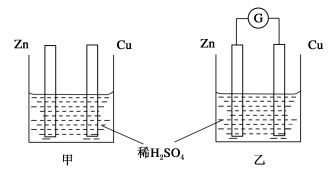
(1)以下叙述中,正确的是__________。
A.甲中锌片是负极,乙中铜片是正极
B.两烧杯中铜片表面均有气泡产生
C.两烧杯中溶液pH均增大
D.产生气泡的速度甲中比乙中慢
E.乙的外电路中电流方向Zn→Cu
(2)变化过程中能量转化的形式主要是:甲为__________;乙为__________。
(3)在乙实验中,如果把硫酸换成硫酸铜溶液,请写出铜电极的电极反应方程式:_____________________________________________________________
②氢氧燃料电池,是一种高效无污染的清洁电池它分碱性(用KOH做电解质)和酸性(用硫酸做电解质)氢氧燃料电池,
(1)如果是碱性燃料电池则负极反应方程式是: .
(2)如果是酸性燃料电池则负极反应方程式是: .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某无色溶液中含有K+、Cl-、OH-、SO32-、SO42-,为检验溶液中所含的某些阴离子,限用的试剂有:盐酸、硝酸、硝酸银溶液、硝酸钡溶液、溴水和酚酞试液。检验其中OH-的实验方法省略,检验其他阴离子的过程如下图所示。
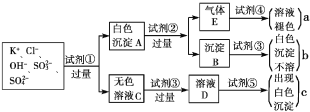
(1)图中试剂①~⑤溶质的化学式分别是
① ,② ,③ ,④ ,⑤ 。
(2)图中现象a、b、c表明检验出的离子分别是a 、b 、c 。
(3)白色沉淀A加试剂②反应的离子方程式是____________________________
(4)无色溶液C加试剂③的主要目的是____________________________
(5)白色沉淀A若加试剂③而不加试剂②,对实验的影响是____________________________
(6)气体E通入试剂④发生反应的离子方程式是____________________________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com