
����Ŀ�����ݻ�Ϊ2L���ܱ������н������·�Ӧ��A��g��+2B��g��![]() 3C��g��+nD��g������ʼʱAΪ4mol��BΪ6mol��5minĩʱ���C�����ʵ���Ϊ3mol����D��ʾ�Ļ�ѧ��Ӧ����v��D��Ϊ0.2mol/��L��min��������
3C��g��+nD��g������ʼʱAΪ4mol��BΪ6mol��5minĩʱ���C�����ʵ���Ϊ3mol����D��ʾ�Ļ�ѧ��Ӧ����v��D��Ϊ0.2mol/��L��min��������
��1��5minĩA�����ʵ���Ũ��Ϊ__________ mol/L��
��2��ǰ5min����B��ʾ�Ļ�ѧ��Ӧ����v��B��Ϊ___________ mol/��L��min����
��3����ѧ����ʽ��nֵΪ__________��
��4���˷�Ӧ�����ֲ�ͬ����µķ�Ӧ���ʷֱ�Ϊ��
��v��A��=5mol/��L��min��
��v��B��=6mol/��L��min��
��v��C��=4.5mol/��L��min��
��v��D��=8mol/��L��min��
���з�Ӧ����������__________�����ţ���
���𰸡���1��1.5mol/L����2��0.2mol/��Lmin������3��2����4����
��������
�����������1�� A��g��+2B��g��![]() 3C��g��+nD��g��
3C��g��+nD��g��
��ʼ����mol�� 4 6 0 0
�仯����mol�� 1 2 3
5minĩ����mol��3 4 3
��1����5minĩA��Ũ����c��A��=n��V=3mol��2L=1.5mol/L��
��2������B��Ũ����2mol��2L��1mol/L����v��B����1mol/L��5min=0.2mol/��Lmin����
��3������ͬһ��Ӧ�С�ͬһʱ����ڣ������ʵķ�Ӧ����֮�ȵ��ڼ�����֮�ȣ�����v��B����v��D��=0.2mol/��Lmin����0.2mol/��Lmin��=2��n������n=2��
��4�����������ʶ������A�ķ�Ӧ���ʣ���v��A��=5mol/��Lmin��������v��B��=6 mol/��Lmin��֪��v��A��=3mol/��Lmin��������v��C��=4.5mol/��Lmin��֪��v��A��=1.5mol/��Lmin��������v��D��=8mol/��Lmin��֪��v��A��=4mol/��Lmin���ɼ���ѧ��Ӧ���������Ǣ١�



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��Ϊ�ᴿ�������ʣ�������Ϊ���ʣ�����ѡ�����Լ��ͷ��뷽������ȷ����
ѡ�� | ���ᴿ�����ʣ����ʣ� | �����Լ� | ���뷽�� |
A | NH3��H2O�� | Ũ���� | ϴ�� |
B | �������������ᣩ | ����̼������Һ | ��Һ |
C | KCl���壨I2�� | KOH��Һ | ���� |
D | �������ӣ� | Ũ��ˮ | ���� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������й�ʵ����ʵ�Ľ�������ȷ����
ѡ�� | ���� | ���� |
A | ʵ���Ҳ������ƺ���Fe3+��MnO4����SO42����Ba2+��������Һ | Fe3+ˮ������� |
B | ����H+��Fe2+����Һ�в��ܴ�������Ag+ | ����Ag+����Һ��Ȼ����NO3���������������£�������Fe2+ |
C | ������ͨ��ˮ�У��γɵ�ˮ��Һ�ܵ��� | �����ǵ���� |
D | ��FeBr2��Һ��ͨ�����Cl2����Һ��Ϊ�ػ�ɫ | ������Ӧ2Fe2++Cl2===2Fe3++2Cl�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼΪ�������ȡ����Ӧ��ʵ��װ��ͼ������AΪ�ɾ���֧�ܵ��Թ��Ƴɵķ�Ӧ�����������¶˿���һ��С�ף�����ʯ���ޣ��ټ���������м�ۡ�
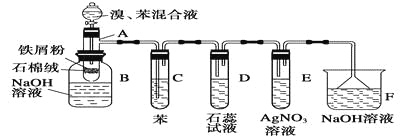
��д���пհף�
��1����Ӧ����A����μ�����ͱ��Ļ��Һ���������ھͷ�����Ӧ��д��A����������Ӧ�Ļ�ѧ����ʽ���л���д�ṹ��ʽ����_________________________________________��
��2���Թ�C�б���������__________________����Ӧ��ʼ�۲�D��E���Թܣ�����������Ϊ________________________________________________________________________��
��3����Ӧ2��3 min����B�е�NaOH��Һ��ɹ۲쵽��������
________________________________________________________________________��
��4������������װ���У����з��������õ�������________������ĸ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������ʮ��Ԫ�أ���Ԫ�����ڱ��е�λ����ͼ��ʾ���ش��������⣺

��1��������ʮ��Ԫ���У��û��������������ǿ��Ԫ��Ϊ ���ѧ���ţ���ͬ��������������ˮ�����������ǿ�Ļ�����Ļ�ѧʽ�� ��������ǿ�Ļ�����Ļ�ѧʽ�� �������Ե���������Ļ�ѧʽ�� ��ԭ�Ӱ뾶����Ԫ���� ���뾶��С�������� ��
��2������ʮ��Ԫ���У���������ǿ��Ԫ�������ڱ��е�λ���ǵ� ���� �壬��Ԫ�صĵ����ڿ�����ȼ�յĻ�ѧ����ʽΪ ��
��3�����õ���ʽ��ʾԪ���������γɷ��ӵĹ��� ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��(2016������ģ��)��ҵ��ͨ����������(��Ҫ�ɷ�ΪAl2O3����������Fe2O3��SiO2������)Ϊԭ���Ʊ���ˮ�Ȼ�����2Al2O3��6Cl2![]() 4AlCl3��3O2��
4AlCl3��3O2��
��1��Ϊ�ٽ���Ӧ�Ľ��У�ʵ������������뽹̿����ԭ����_____________________��
��2�����뽹̿��Ļ�ѧ��Ӧ�ɱ�ʾΪAl2O3��C��Cl2AlCl3��X�������ʵ��ȷ������X��__________________��
��3�����ᴿAlCl3�ֲ�Ʒʱ��������������ۣ���ʹ�۵�ϵ͵�FeCl3ת��Ϊ�۵�ϸߵ�FeCl2���Ӷ�������AlCl3�л��������Ȼ���÷�Ӧ�Ļ�ѧ����ʽΪ________________________��
��4����������Ϊԭ�Ͽ���ͨ������;���ᴿ��������

��д����Һ�������ʵĻ�ѧʽ��___________________________��
��д����Һ���м��������ˮ�õ�Al(OH)3�����ӷ���ʽ��__________________________��
��Ҫ��һ����ý���������ҵ�ϲ��õ�ұ��������_______________��
�йط�Ӧ�Ļ�ѧ����ʽΪ________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����и�����������A��B��C��D�������Ϣ��
����A�����е����к�̼������������ͣ�
����B��һ��ֲ���������ڼ��������ڴ����ʵ��
����C��������ȼ�ղ�������Ȳ�泣�����и�ӽ�����
����D�ķ��ӱ���ģ����ͼ��ʾ��
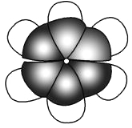
�ݴ˻ش��������⣺
��1��д��A�����������·�Ӧ�Ļ�ѧ����ʽ��ֻд��һ����Ϊ ��
��2����1mol A��������Cl2��Ϻ���գ�������������л�ȡ���������ʵ�����ȣ������ĵ��������ʵ�����____________��
��3��д��B��ˮ�ڴ��������·�Ӧ�Ļ�ѧ����ʽ�� ��
��4��д��C������������Ȼ�̼��Һ��Ӧ�Ļ�ѧ����ʽ�� ��
��5��D�����в�����һ���̼̼������̼̼˫������Ľṹ��������֤ʵ��һ��ʵ���� ��
a��D����λ����ȡ���ﲻ����ͬ���칹��
b��D�ļ�λ����ȡ���ﲻ����ͬ���칹��
c��D ����ʹ������Ȼ�̼��Һ��ɫ
d��D���ܱ����Ը��������Һ����
e��D�ڴ����������������������ӳɷ�Ӧ
��6��д��D��Ũ���ᡢŨ�����Ϻ������50����60����Ӧ�Ļ�ѧ����ʽ��___________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼΪij�ּ״�ȼ�ϵ��ʾ��ͼ������ʱ����������ͼ��ʾ�������ж���ȷ����
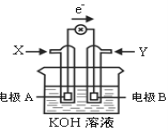
A��X����
B���缫A��Ӧʽ��CH3OH-6e-+H2O = CO2+6H+
C��B�缫������ҺpH����
D����ع���ʱ����Һ�е����ɵ缫B����缫A
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����д�ʩ�϶���ʹ��ѧƽ���ƶ�����
A. ����Ӧ����� B. ����ѹǿ C. �����¶� D. ʹ�ô���
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com