
����Ŀ������ֲ���纣���������к��зḻ�ĵ�Ԫ�أ���Ҫ�Ե⻯����ʽ���ڡ���һ��ѧ����С���ú���Ϊԭ����ȡ�����ⵥ�ʣ����ǽ��������ճɻң���ˮ����һ��ʱ�䣨�⻯�����ܽ���ˮ�У����õ�����������Һ��Ȼ������ʵ��������ȡ���ʵ⣺����֪��2I-+Cl2=2Cl-+I2��
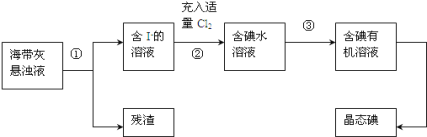
(1)ָ����ȡ��Ĺ������йص�ʵ��������ƣ���______���� _____��
(2)���̢��г�������Cl2��Ŀ����(�÷���ʽ����)_________________������Һ�е�I-ת����I2��
(3)�����������õ��л��Լ�������______________(ֻ��һ��)��
(4)�������̢ۿ��Էֽ�Ϊ���¼�����
A.��ʢ����Һ�ķ�Һ©����������̨����Ȧ�У�
B.��50mL��ˮ��15mL�л��ܼ������Һ©���У����Ǻò�������
C.�����Һ©���������ϿڵIJ������Ƿ�©Һ��
D.��ת©������������ʱ�����������������رջ������ѷ�Һ©��������
E.�������������ձ�������Һ��
F.�ӷ�Һ©���Ͽڵ����ϲ�Һ�壻
G.��©���ϿڵIJ�������ʹ���ϵİ�����©���Ͽڵ�С����
H.���á��ֲ㡣
���̢���ȷ���������˳���ǣ���������ĸ��_______��________��________��A��H��________��E��F��
���𰸡����� ��ȡ����Һ 2I-+Cl2=2Cl-+I2 ��(�����Ȼ�̼) C B D G
��������
�Ժ���Ϊԭ�ϻ�������ⵥ�ʣ������������������յõ������ң��������ҽ��ݵõ�����������Һ��Ȼ����ù��˵ķ�������������Һ���룬�õ����е⻯�ص���Һ����ˮ��Һ��ͨ������Cl2��������ӦΪ2I-+Cl2=2Cl-+I2�����еⵥ�ʵ���Һ�м�����ȡ�����Ȼ�̼��ȡ����õ��ⵥ�ʡ�
(1)�������ǽ���Һ�Ͳ����Թ������ķ����ǹ��ˣ��������Ǵӵ�ˮ�л�ȡ�ⵥ�ʲ�����ȡ����Һ�ķ�����
(2)���̢�ͨ��������Cl2���Խ�I-�������ɵ�I2����Ӧ����ʽΪ��2I-+Cl2=2Cl-+I2��
(3)����������I2���������л��ܼ�������ˮ���ܽ�Ȳ���ˮ���л��ܼ��������ݣ������е��ˮ��Һ���з��룬ʹ�õ��л�������DZ������Ȼ�̼������һ�֣�
(4)��ʵ�鲽���Ǽ�©����ҩƷ�������á����á�����������������������Һ�壬���������˳����CBDAHGEF��


 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����������(NOx)���ж��Ĵ�����Ⱦ��о����֣����Բ�����ͼװ����Чȥ���������������˵����ȷ���ǣ� ��
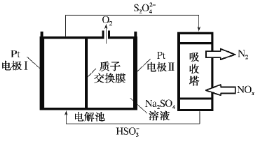
A.Pt�缫II��Pt�缫I���Ƶ�
B.�������У�Pt�缫I�Ϸ�����Ӧ��2HSO![]() +2e-=S2O
+2e-=S2O![]() +2OH-
+2OH-
C.�������У�����pH����С
D.ת��1mol����ʱ��������������0.5molS2O![]()
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����и�����������Һ�п��Դ������棬�Ҽ����ͨ���Լ�X������Ӧ�����ӷ���ʽ��ȷ����
ѡ�� | ������ | �Լ�X | ������Ӧ�����ӷ���ʽ |
A | K+��Na+�� | ����HCl | H2O+H++ |
B |
| ����H2S | Fe2++H2S=FeS��+2H+ |
C | ClO-��Na+��Ca2+�� | ����CO2 | CO2+Ca2++H2O+2ClO-=CaCO3��+2HClO |
D | I-��Cl-��Na+�� | ����ϡ���� | 6I-+2 |
A.AB.BC.CD.D
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��һ���¶��£�10mL0.40mol��L-1����������Һ�������ֽ⡣��ͬʱ�̲���������������(������Ϊ��״��)���±���
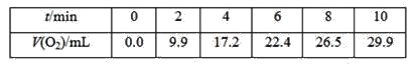
������������ȷ����(��Һ����仯���Բ���)�� ��
A.0��6min��ƽ����Ӧ���ʣ�v(H2O2)��3.3��10-2mol��L-1��min-1
B.6��10min��ƽ����Ӧ���ʣ�v(H2O2)<3.3��10��2mol��L-1��min-1
C.��Ӧ��6minʱ��c(H2O2)��0.30mol��L-1
D.��Ӧ��6minʱ����������ֽ���50%
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij�о�С��ͬѧΪ̽��п�����ᷴӦ����SO2��H2���ٽ�Ũ��(Ũ��������п��Ӧ����SO2�����Ũ��)���������ʵ�顣�ڴ��Թ�A�м���100mL 18mol/L���ᣬ�����������ϰ��ϵĶ���������ڼ���������п��(���ϰ����������ƶ�)�����Լ�ƿD�м���������ŨNaOH��Һ(���Ⱥͼг�װ����ʡ��)��
��֪��п��Ũ����Ӵ�����ʼʱ��Ӧ�����������ʵ������Լ����䷴Ӧ�����д�����������ʱ���÷�Ӧ���ʻ����Լӿ첢���д������ȷų���
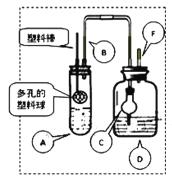
(1)��д��п�����ᷴӦ����SO2�Ļ�ѧ����ʽ_______��
(2)����װ����֮�����Լ�֮ǰ������еIJ�����__________��
(3)������B��������______�����û�������ƣ����ղⶨ���ٽ�Ũ�Ȼ�_______��(����ƫ��������ƫ����������Ӱ����)
(4)װ���и����C��������_______��
(5)��Ӧ��������Dװ���м���������H2O2��Һ��������BaCl2��Һ����ַ�Ӧ�����ó������ˡ�ϴ�ӡ���������õ���������Ϊa�ˣ���Ũ������п��Ӧ���ٽ�Ũ��Ϊ��_________mol/L��(�ú�a�ļ���ʽ��ʾ����������仯)
(6)ijͬѧͨ����ϵ������ԭ��Ӧ�����֪ʶ����ΪҲ�������������ữ�ĸ��������Һ��D�е�SO![]() ���еζ���ͨ���ζ�����SO
���еζ���ͨ���ζ�����SO![]() �����ʵ��������ٽ�Ũ�ȣ�����Ϊ������һ�뷨�Ƿ����?______(����������������������)��ԭ����_____��
�����ʵ��������ٽ�Ũ�ȣ�����Ϊ������һ�뷨�Ƿ����?______(����������������������)��ԭ����_____��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��̼Ԫ�����γɵ��ʼ��仯������������Ԫ�ء��ش��������⣺
��1��̼�����⡢����������Ԫ�ع��ɻ�����CO(NH2)2���÷����и�Ԫ�صĵ縺���ɴ�С��˳��Ϊ_________������Cԭ�ӵ��ӻ���ʽΪ__________��������������ˮ����Ҫԭ����_______________��
��2��CO��̼Ԫ�صij����������N2��Ϊ�ȵ����壬��CO�ĽṹʽΪ_______��CO���Ժͺܶ���ɽ����γ�������Ni(CO)4��д����̬Niԭ�ӵĵ����Ų�ʽ__________��
��3��̼��ij�־���Ϊ��״�ṹ���������ڽ��������á���ԭ������ڸ���֮�䣬�γɼ�϶������䳣���ṹ��ƽ��ͶӰ��ͼ����ʾ�����仯ѧʽ�ɱ�ʾΪ__________

��4��ͼ��Ϊ̼��һ��ͬ��������C60���ӣ�ÿ��C60�����к�����������ĿΪ________��
��5��ͼ��Ϊ̼����һ��ͬ����������ʯ�ľ���������ԭ���������AΪ��0��0��0����BΪ��1/2��0��1/2����CΪ��1/2��1/2��0������Dԭ�ӵ��������Ϊ__________��
��6��������������Ľṹ����ʯ���ƣ�Ӳ������ʯ�൱�������߳�Ϊ361.5 pm��������������ܶ���___________g���M-3���г�����ʽ���ɣ������ӏ�����ΪNA����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ס��ҡ������������Ǻϳɾ��������ֵĻ���ԭ�ϣ�����˵���д�����ǣ� ��
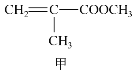
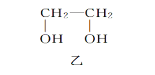
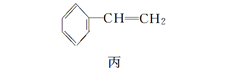
A.1mol�ҿ���2mol����ȫ��Ӧ����1mol����
B.����������ֻ�мͱ��ܹ�ʹ���Ը��������Һ��ɫ
C.�ͱ���һ�������·�����ͬ���͵ķ�Ӧ
D.�������Ҷ��ᷴӦ�ɻ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����������װ��ģ���������Ƽ����ͨ���Ʊ���NH3��CO2���뱥��ʳ��ˮ��Ӧ���Ʊ�NaHCO3������˵����ȷ����( )
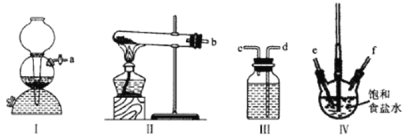
A.ʵ��ʱװ��������������Ӧ��ͨ�뵽װ������
B.װ�����е��Լ�ΪŨ����
C.���ܿڵ�����˳��Ϊa��e��f��d��c��b
D.ʵ������У�װ�����ڻ���ֻ�������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ijѧϰС��̽�����Ļ�ԭ�Լ������������ʣ�����ͼװ�ý���ʵ��(ͼ�мг�װ������ȥ)����B�����������������������ȣ��ٹ����������֪����ˮ�Ȼ��ƿ����հ�����ˮ���ش��������⣺
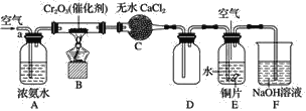
(1)B�з�����Ӧ�Ļ�ѧ����ʽ��______________________________��
(2)֤������������������������________________����Ӧ�ķ���ʽ��________________��
(3)E��ͭ������Ӧ�����ӷ���ʽ��________________________________��
(4)E�л���ͨ�������Ŀ����____________________________________��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com