
【题目】铜与锌用导线连接后,插入稀硫酸中形成原电池。
(1)分析图并填空:__。
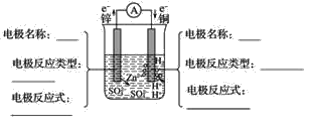
(2)原电池总反应式(离子方程式)__。
(3)上述装置产生电流的原因是__。
(4)上述装置的能量转化是__。
【答案】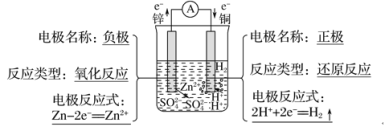 Zn+2H+=Zn2++H2↑ 锌与稀硫酸发生氧化还原反应,有电子转移,负极锌失去的电子沿导线流向正极铜,闭合回路中有电流产生 化学能转化为电能
Zn+2H+=Zn2++H2↑ 锌与稀硫酸发生氧化还原反应,有电子转移,负极锌失去的电子沿导线流向正极铜,闭合回路中有电流产生 化学能转化为电能
【解析】
在铜锌原电池中,锌与稀硫酸发生氧化还原反应,有电子转移,即锌失去的电子沿导线流向铜,闭合回路中形成电流,化学能转化为电能。由于锌的活动性大于铜,锌为原电池的负极,失去电子发生氧化反应,电极反应式为Zn-2e-=Zn2+,锌片逐渐溶解;铜为原电池的正极,溶液中的氢离子在正极上得到电子发生还原反应,电极反应式为2H++2e-=H2↑,铜片表面产生大量气泡,以此解题。
在铜锌原电池中,锌与稀硫酸发生氧化还原反应,有电子转移,即锌失去的电子沿导线流向铜,闭合回路中形成电流,化学能转化为电能。由于锌的活动性大于铜,锌为原电池的负极,失去电子发生氧化反应,电极反应式为Zn-2e-=Zn2+,锌片逐渐溶解;铜为原电池的正极,溶液中的氢离子在正极上得到电子发生还原反应,电极反应式为2H++2e-=H2↑,铜片表面产生大量气泡。
(1)根据分析,该题图为: ,
,
故答案为: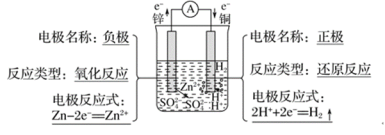 ;
;
(2)根据分析,由于锌的活动性大于铜,锌为原电池的负极,电极反应式为Zn-2e-=Zn2+,铜为原电池的正极,电极反应式为2H++2e-=H2↑,原电池总反应式(离子方程式) Zn+2H+=Zn2++H2↑,
故答案为:Zn+2H+=Zn2++H2↑;
(3)该装置产生电流的原因是:在铜锌原电池中,锌与稀硫酸发生氧化还原反应,有电子转移,即锌失去的电子沿导线流向铜,闭合回路中形成电流,
故答案为:锌与稀硫酸发生氧化还原反应,有电子转移,负极锌失去的电子沿导线流向正极铜,闭合回路中有电流产生。
(4)根据分析可知,该装置是原电池,原电池是将化学能转化为电能的装置,
故答案为:化学能转化为电能。


 灵星计算小达人系列答案
灵星计算小达人系列答案 孟建平错题本系列答案
孟建平错题本系列答案科目:高中化学 来源: 题型:
【题目】BASF高压法制备醋酸,所采用钴碘催化循环过程如图所示,则下列观点错误的是( )
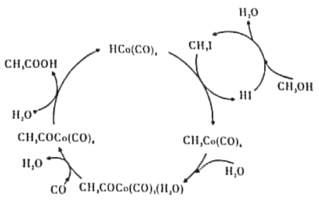
A.CH3OH转化为CH3I的有机反应类型属于取代反应
B.从总反应看,循环过程中需不断补充CH3OH、H2O、CO等
C.与乙酸乙酯互为同分异构体且与CH3COOH互为同系物的物质有2种结构
D.工业上以淀粉为原料也可以制备醋酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表列出了9种元素在元素周期表中的位置示意。
周期 | ⅠA 1 | 0 18 | ||||||
1 | ⅡA 2 | ⅢA 13 | ⅣA 14 | ⅤA 15 | ⅥA 16 | ⅦA 17 | ||
2 | ① | ② | ③ | ④ | ⑤ | |||
3 | ⑥ | ⑦ | ⑧ | |||||
4 | ⑨ | |||||||
请回答下列问题:
(1)考古工作者利用元素②的一种核素测定一些文物的年代,这种核素的符号是_____
(2)画出元素⑧形成的简单离子的结构示意图_________________
(3)写出元素④和⑥的单质在加热条件下反应,所得产物的电子式为_________
(4)⑥元素的最高价氧化物对应的水化物含有的化学键是__________________
(5)②、③、④、⑤四种元素的简单气态氢化物中,稳定性最强的是_______(填化学式),写出元素⑥的单质与水反应的离子反应方程式___________________,写出一个能证明元素⑧比元素⑨非金属性强的反应事实的离子方程式__________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究小组同学为探究锌与硫酸反应生成SO2、H2的临界浓度(浓硫酸能与锌反应生成SO2的最低浓度)设计了如下实验。在大试管A中加入100mL 18mol/L硫酸,向连接在塑料棒上的多孔塑料球内加入足量的锌粒(塑料棒可以上下移动),在试剂瓶D中加入足量的浓NaOH溶液(加热和夹持装置已省略)。
已知:锌与浓硫酸接触,开始时反应缓慢,可以适当加热以加速其反应,当有大量气泡生成时,该反应速率会明显加快并伴有大量的热放出。
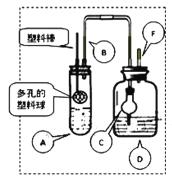
(1)请写出锌与硫酸反应产生SO2的化学方程式_______。
(2)在组装仪器之后,加入试剂之前必须进行的操作是__________。
(3)长导管B的作用是______,如果没有这个设计,最终测定的临界浓度会_______。(填“偏高”、“偏低”或“无影响”)
(4)装置中干燥管C的作用是_______。
(5)反应结束后向D装置中加入足量的H2O2溶液和足量的BaCl2溶液,充分反应后将所得沉淀过滤、洗涤、干燥、称量得到固体质量为a克,则浓硫酸与锌反应的临界浓度为:_________mol/L。(用含a的计算式表示,忽略体积变化)
(6)某同学通过联系氧化还原反应的相关知识,认为也可以利用硫酸酸化的高锰酸钾溶液对D中的SO![]() 进行滴定,通过滴定出的SO
进行滴定,通过滴定出的SO![]() 的物质的量计算临界浓度,你认为他的这一想法是否可行?______(填“可行”或“不可行”),原因是_____。
的物质的量计算临界浓度,你认为他的这一想法是否可行?______(填“可行”或“不可行”),原因是_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】世界某著名学术刊物介绍了一种新型中温全瓷铁空气电池,其结构如图所示。

下列有关该电池放电时的说法正确的是( )
A.a极发生氧化反应
B.正极的电极反应式为FeOx+2xe-=Fe+xO2-
C.若有22.4 L(标准状况)空气参与反应,则电路中有4 mol电子转移
D.铁表面发生的反应为xH2O(g)+Fe=FeOx+xH2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲、乙、丙三种物质是合成聚酯玻璃钢的基本原料,下列说法中错误的是( )
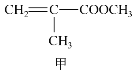
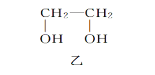
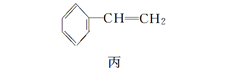
A.1mol乙可与2mol钠完全反应生成1mol氢气
B.三种物质中只有甲和丙能够使酸性高锰酸钾溶液褪色
C.甲和丙在一定条件下发生相同类型的反应
D.乙能与乙二酸反应成环
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,装置在常温下工作(溶液体积变化忽略不计)。闭合K,灯泡发光。下列叙述中不正确的是( )
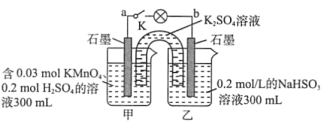
A.电池工作时,甲烧杯发生的反应为MnO4-被还原生成MnO2
B.电池工作时,盐桥中的K+移向甲烧杯,外电路的电子方向是从b到a
C.乙中电极反应为HSO3--2e-+H2O=SO42-+3H+
D.当电路中有1.204×1022个电子转移时,乙烧杯中溶液的H+浓度约为0.1mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知X、Y、Z、W四种元素是元素周期表中连续三个不同短周期的元素,且原子序数依次增大。X、W同主族,Y、Z为同周期的相邻元素。W原子的质子数等于Y、Z原子最外层电子数之和。Y的氢化物分子中有3个共价键。Z原子最外层电子数是次外层电子数的3倍。试推断:
(1)X、Y、Z、W四种元素的符号: X________、Y__________、Z____________、W、________
(2)由以上元素中的两种元素组成的能溶于水且水溶液显碱性的化合物的电子式分别为__________________,______________________。
(3)由X、Y、Z所形成的离子化合物是________________,它与W的最高氧化物的水化物的浓溶液加热时反应的离子方程式是________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)请用化学方程式写出如何检验牙膏中存在甘油的方法___。
(2)Ca3N2是离子化合物,各原子均满足8电子稳定结构。写出Ca3N2的电子式___。
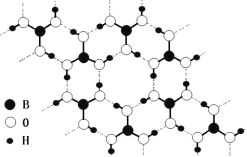
(3)常温常压下硼酸(H3BO3)晶体结构为层状,其二维平面结构如图。1mol硼酸(H3BO3)晶体中含有___mol氢键。从氢键的角度解释硼酸在冷水中的溶解度小而加热时溶解度增大:___。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com